
Lerntext Stoffwechselphysiologie
Roland Heynkes 1.7.2019, CC BY-SA-4.0 DE
If you cannot read German-language texts, you could try a translation into your native language with DeepL.
Auf dieser Seite sammle ich zum Nachlesen und Lernen für Lernende der Erprobungsstufe oder interessierte Biochemie-Differenzierungskurse der Jahrgangsstufe 9, was wir zum Thema Stoffwechsel-Physiologie bzw. zur Steuerung und Regulation des Stoffwechsels durch Enzyme (Enzymatik) erarbeiten.

| Aufgaben zur Erarbeitung des Lernstoffes: | |
|---|---|
| a1 | Beschreibe allgemein die Bedingungen, die für das Leben eines Lebewesens und das Laufen einer mechanischen Uhr erfüllt sein müssen! |
| a2 | Nenne die Zustände einer Uhr, die sich mit einem a) lebenden, b) toten oder c) in einer Pause vom Leben befindlichen Lebewesen vergleichen lassen! |
| a3 | Beschreibe den im Lerntext erwähnten grundsätzlichen Unterschied zwischen technischen Systemen wie Autos und Uhren einerseits und aktiv lebenden Lebewesen und Zellen andererseits! |
| a4 | Erkläre den Unterschied zwischen den Begriffen Edukt und Substrat! |
| a5 | Definiere die Begriffe a) Stoffwechsel und b) Fließgleichgewicht! |
| Hier geht es zu den Lösungen. | |
möglicherweise neue "Fachbegriffe":
|
Ein menschlicher Organismus kann nur funktionieren und aktiv leben, wenn viele Organe ihre jeweiligen Aufgaben erfüllen und genau aufeinander abgestimmt wie die Rädchen eines Uhrwerks zusammen arbeiten. Ganz ähnlich kann eine eukaryotische Zelle nur dann als kleinste lebende Einheit funktionieren und aktiv leben, wenn ihre Organellen exakt reguliert und koordiniert wie die Bauteile eines Autos zusammen arbeiten. Denn jedes Lebewesen und sogar jede Zelle ist ein System (genauer ein offenes System). Es gibt allerdings auch Lebewesen (z.B. Bakterien, Bärtierchen oder in flüssigem Stickstoff lagernde menschliche Embryonen), die eine Pause vom Leben machen und keinen Stoffwechsel betreiben.
| Im Gegensatz zu technischen Systemen wie Autos und Uhren tauschen aktiv lebende Lebewesen und Zellen ständig die Materie aus, aus der sie bestehen (Baustoffwechsel). Dabei erhalten sie auf verschiedenen Ebenen Fließgleichgewichte aufrecht. Das bedeutet, dass sie ihre Strukturen und Funktionen weitgehend unverändert beibehalten, obwohl Zellen durch Auf- und Abbau ständig die Stoffe auswechseln (Baustoffwechsel), aus denen sie bestehen. |
Mit den Nährstoffen nehmen Lebewesen Ionen und Moleküle in sich auf. Makronährstoffe werden durch Verdauungsprozesse in ihre Monomere zerlegt (Katabolismus). Vielzeller transportieren die Monomere und Mikronährstoffe zu den Zellen des Körpers, wo sie als Baustoffe für den Aufbau (Biosynthese, Anabolismus) körpereigener Biomoleküle genutzt werden oder wo aus ihnen chemische Energie für alle Lebensprozesse gewonnen wird. Gleichzeitig werden andere Funktionseinheiten des Organismus wieder in kleinere Bestandteile zerlegt und teilweise ausgeschieden. Obwohl eine Zelle oder ein vielzelliges Lebewesen noch unverändert aussieht, können bereits die meisten seiner Atome ausgetauscht worden sein. Das sich Lebewesen verglichen mit ihren inneren Austauschprozessen nur sehr langsam verändern, liegt an einem präzise gesteuerten Gleichgewicht zwischen den unzähligen Auf- und Abbauprozessen. Dieser geregelte Stoffwechsel und solche Fließgleichgewichte bewahren auch Homöostasen und sind typisch für aktives Leben.
Auch Autos mit Verbrennermotor haben einen Stoffwechsel und im Motor ein Fließgleichgewicht. Anders als lebende Lebewesen haben Autos aber weder Anabolismus noch Baustoffwechsel. Ihr Katabolismus dient nur einem Energiestoffwechsel. Der Verbrennermotor wandelt die chemische Energie relativ langkettiger Kohlenwasserstoffe um in Bewegungsenergie (kinetische Energie). Genau wie wir setzt auch der Verbrennermotor die chemische Energie energiereicher Stoffe mit Hilfe von Sauerstoff frei. Und die energiearmen Produkte dieser Oxidationen sind im Verbrennermotor genau wie in unseren Zellen Wasser und CO2. Allerdings werden Benzin und Diesel genau wie unsere Nahrung durch den Sauerstoff nicht einfach spontan verbrannt. Um die Verbrennung zu starten, braucht es eine sogenannte Aktivierungsenergie. Anders als Lebewesen benutzt dafür der aus stabilem und hitzebeständigem Metall bestehende Verbrennermotor entweder die Hitze eines Zündfunkens (Benziner) oder eines plötzlich erhöhten Drucks (Dieselmotor). Lebewesen überwinden die Hürde der Aktivierungsenergie mit Hilfe von Katalysatoren, denn sie reagieren wesentlich empfindlicher als Motoren auf große Hitze und plötzliche Druck-Änderungen.
Unser Stoffwechsel (Metabolismus) besteht aus unzähligen biochemischen Reaktionen, die fast alle von Enzymen katalysiert werden. Die meisten Stoffwechselprodukte sind Substrate für weitere Stoffwechselreaktionen. Damit im System Stoffwechsel immer nur die jeweils erforderlichen Enzyme räumlich und zeitlich koordiniert (genau aufeinander abgestimmt) arbeiten, unterliegen unsere Stoffwechselwege auf verschiedenen Ebenen unterschiedlichen Regulations-Mechanismen.

Das Folgende haben wir 1977 noch in der EF im Chemie-Grundkurs gelernt. Das und die intensive Beschäftigung mit den Hybridorbitalen verhalfen uns zu einem besseren Verständnis der Organischen Chemie und der von Enzymen gesteuerten Stoffwechselreaktionen. Inzwischen wurde die Thermodynamik aus dem gymnasialen Kernlehrplan gestrichen. Ich möchte dieses Kapitel und den Lerntext Hybridorbitale trotzdem denjenigen empfehlen, die mit dem Abitur einigermaßen auf ein Studium der Chemie oder Biologie vorbereitet sein möchten.
| System nennt man ein aus mehreren Teilen bestehendes Ganzes, das mehr ist als seine Teile, weil diese Teile (meistens räumlich und zeitlich) koordiniert zusammenwirken wirken können. |
Das müssen sie allerdings nicht. So können beispielsweise die Bestandteile einer Uhr, eines Motors oder eines Lebewesens nahezu vollkommen still stehen. Dann sind alle ihre Teile immer noch an ihren richtigen Plätzen und funktionsfähig miteinander verbunden, aber sie tun weder für sich allein noch gemeinsam irgend etwas. Diese Systeme hören aber erst auf, Systeme und Uhren, Motoren oder Lebewesen zu sein, wenn sie kaputt bzw. tot sind. Dann können die Einzelteile nicht mehr zusammenwirken und das zuvor von ihnen gebildete Ganze hört auf zu existieren, auch wenn man meint es noch sehen zu können. Denn kaputte ehemalige Uhren oder Autos und Leichen können nicht immer von nur stillstehenden Uhren oder Autos und Lebewesen unterschieden werden. Manchmal erkennt man den Unterschied erst, wenn technische Systeme wieder ihre Funktion aufnehmen oder ein Lebewesen seine Pause vom Leben beendet und wieder lebt. Einfach ist die Unterscheidung zwischen Lebewesen und Leichen oder allgemein Systemen und deren nicht mehr funktionsfähigen Einzelteilen auch deshalb nicht, weil Schrott repariert werden kann und Scheintote oder Sterbende ohne jede Herz- und Hirnfunktion manchmal wiederbelebt werden können. Der Übergang vom funktionsfähigen zum kaputten bzw. toten ehemaligen System kann fließend sein.
Lebewesen sind nicht nur Systeme in diesem Sinne. Sie sind gleichzeitig auch thermodynamische Systeme. So nennt man einen von seiner Umwelt abgegrenzten Raum, dessen Inhalt sich durch die Gesetze der Thermodynamik beschreiben lässt. Dabei muss es sich nicht um ein System in dem Sinne handeln, dass es aus zusammen wirkenden Teilen besteht, die durch ihr Zusammenwirken etwas neues, größeres schaffen. Ein thermodynamisches System kann einfach ein auf Wasser schwimmendes Stück Eis sein oder das Wasser in einem Becher.
| Thermodynamische Systeme sind von ihren Umwelten abgegrenzte Räume, deren Inhalte sich durch die Gesetze der Thermodynamik beschreiben lassen. |
| Physiker und Biologen nennen thermodynamische Systeme offen, wenn sie mit ihren Umgebungen Stoffe UND Energie austauschen können. Geschlossene thermodynamische Systeme können mit ihren Umgebungen nur Energie, aber keine Materie austauschen. Da es keine hundertprozentigen Isolierungen gibt, existieren abgeschlossene thermodynamische Systeme nur theoretisch, denn sie könnten definitionsgemäß mit ihren Umgebungen weder Materie noch Energie austauschen. |
Verglichen mit den Geschwindigkeiten chemischer Reaktionen ändern sich Temperatur und Druck in Zellen nur langsam. Man kann also bei den unzähligen, in lebenden Zellen ablaufenden chemischen Reaktionen davon ausgehen, dass Temperatur und Druck praktisch konstant bleiben. Unter diesen Umständen lässt sich mit folgender, relativ einfacher Gleichung ermitteln, ob eine chemische Reaktion thermodynamisch günstig ist:
ΔF = ΔU - T · ΔS
F steht für die freie Energie eines thermodynamischen Systems (z.B.: der an einer chemischen Reaktion besteiligten Edukte und Produkte). Die absolute Größe dieser freien Energie kann nicht bestimmt werden, sondern lediglich deren Änderungen ΔF.
U steht für die innere Energie (die gesamte für thermodynamische Umwandlungsprozesse zur Verfügung stehende Energie) des thermodynamischen Systems (der an einer chemischen Reaktion besteiligten Stoffe). Die absolute Größe dieser inneren Energie U kann nicht bestimmt werden, sondern lediglich deren Änderungen ΔU. Durch den Austausch von Wärme, Licht oder Arbeit kann sich die innere Energie eines thermodynamischen Systems ändern.
S steht für die Entropie, also die molekulare Unordnung. T steht für die absolute Temperatur (in Kelvin) und Δ für eine Änderung.
Freiwillig laufen Prozesse nur bei nicht positivem ΔF ab. Ist ΔF gleich Null, dann ist der Prozess reversibel. Ist die Änderung der freien Energie ΔF negativ, dann ist die freie Energie der Produkte niedriger ist als die freie Energie der Edukte und die chemische Reaktion ist thermodynamisch günstig. Solche chemischen Reaktionen nennt man exergonisch. Der Grund kann eine Abnahme der inneren Energie sein, also ein negatives ΔU. Chemische Reaktionen können aber auch angetrieben werden durch eine Zunahme der Entropie (Die Temperatur T bleibt ja praktisch konstant.). Bei reversiblen exergonischen chemischen Reaktionen läuft die Hinreaktion von den Edukten zu den Produkten leichter ab als die Rückreaktion und es gibt im Gleichgewichtszustand mehr Produkte als Edukte. Exergonische chemische Reaktionen können spontan/freiwillig, also ohne Energiezufuhr von außen ablaufen. Oft benötigen sie aber anfangs die Zufuhr von Aktivierungsenergie.
Ähnlich verhält es sich mit der freien Enthalpie oder Gibbs Energie eines thermodynamischen Systems:
ΔG = ΔH - T · ΔS
G steht für die freie Enthalpie oder Gibbs Energie eines thermodynamischen Systems (z.B.: der an einer chemischen Reaktion besteiligten Edukte und Produkte). Die absolute Größe dieser Gibbs Energie kann nicht bestimmt werden, sondern lediglich deren Änderungen ΔG.
H steht für die Enthalpie des thermodynamischen Systems (der an einer chemischen Reaktion besteiligten Stoffe). Die absolute Größe dieser Enthalpie kann nicht bestimmt werden, sondern lediglich deren Änderungen ΔH.
S steht für die Entropie, also die molekulare Unordnung. T steht für die absolute Temperatur (in Kelvin) und Δ für eine Änderung.
Ist bei einem Prozess die Änderung der Gibbs Energie eines thermodynamischen Systems ΔG negativ, dann kann der Prozess spontan ablaufen. Solche Prozesse müssen nicht chemische Reaktionen sein. In Mitochondrien zum Beispiel wird die freie Enthalpie (Gibbs Energie) der in Glykolyse und Zitratzyklus produzierten FADH2- und NADH-Moleküle genutzt, um im Rahmen der Atmungskette einen Ionen-Gradienten aufzubauen, dessen freie Enthalpie dann in die freie Enthalpie des universellen Energieträgers ATP überführt wird.
In lebenden Systemen laufen auch viele chemische Reaktionen ab, bei denen die freie Energie der Produkte höher ist als die freie Energie der Edukte. Solche chemischen Reaktionen nennt man endergonisch. Sie bedürfen einer ständigen Energiezufuhr, denn sie sind thermodynamisch ungünstig. Deshalb läuft die Hinreaktion von den Edukten zu den Produkten weniger leicht ab als die Rückreaktion. Im Gleichgewichtszustand sind deshalb weniger Produkte als Edukte vorhanden.
|
Exergonische chemische Reaktionen verwandeln zunächst Edukte (Ausgangsstoffe) in Produkte. Nehmen aber die Konzentrationen der Produkte zu und ist die chemische Reaktion reversibel (Das sind fast alle chemischen Reaktionen.), dann kommt es zu einer immer umfangreicheren Rückreaktion, bis sich bei irgendeinem Verhältnis von Edukten zu Produkten ein Gleichgewicht einstellt. Und weil in lebenden Zellen ständig Edukte nachgeliefert und Produkte verbraucht oder abtransportiert werden, bilden auch die chemischen Reaktionen in lebenden Zellen Fließgleichgewichte.
Vom Gegensatzpaar exergonischer und endergonischer chemischer Reaktionen zu unterscheiden ist das Gegensatzpaar endothermer und exothermer chemischer Reaktionen. In der Chemie nennt man chemische Reaktionen endotherm, wenn sie bei konstantem Druck und Volumen insgesamt Energie "verbrauchen" oder genauer gesagt von außen zugeführte Energie in chemischen Bindungen als chemische Energie speichern. Exotherm heißt eine chemische Reaktion, wenn sie bei konstantem Druck und Volumen insgesamt Energie freisetzt, also an die Umgebung abgibt.
|
Setzt eine exotherme chemische Reaktion Energie frei, dann erhöht sie dadurch den Anteil der Teilchen der Ausgangsstoffe, die über die notwendige Aktivierungsenergie verfügen und reagieren können. Dadurch beschleunigen sich exotherme chemische Reaktionen selber und man muss ihnen nur anfangs etwas Aktivierungsenergie zuführen. Während einer endothermen chemischen Reaktion wird der Anteil der Teilchen mit ausreichender Aktivierungsenergie reduziert. Dadurch bremsen endotherme chemische Reaktionen sich selber ab.
Endotherme und exotherme chemische Reaktionen können beide thermodynamisch günstig (exergonisch) oder thermodynamisch ungünstig (endergonisch) sein, weil die Änderung (Δ) der freien Energie (F) nicht nur von der Änderung der inneren Energien (ΔU), sondern auch von der Änderung der Entropie (ΔS) abhängt (ΔF = ΔU - T x ΔS). Mischt man beispielsweise in Wasser komplementäre Oligonukleotide (DNA-Einzelstrang-Fragmente), dann bilden diese DNA-Doppelstränge und reduzieren dadurch die Entropie im Gefäß in erheblichem Maße. Dadurch wird aber der zweite Hauptsatz der Thermodynamik nicht verletzt, weil gleichzeitig Wärme an die Umwelt abgegeben wird.

| Aufgaben zur Erarbeitung des Lernstoffes: | |
|---|---|
| b1 | Beschreibe die Bedeutung der Aktivierungsenergie für einzelne Teilchen! |
| b2 | Erkläre die Bedeutung der Aktivierungsenergie für chemische Reaktionen! |
| b3 | Erkläre, warum ein mehr oder weniger kleiner Teil der Edukt-Teilchen auch ohne Zuführung einer Aktivierungsenergie reagieren kann! |
| b4 | Beschreibe die Kette von Effekten einer Zuführung von Wärmeenergie zu einem Gefäß voller Edukte! |
| b5 | Erkläre die mit zunehmender Raumtemperatur abnehmende Aktivierungsenergie! |
| b6 | Erkläre, warum man exothermen im Gegensatz zu endothermen chemischen Reaktionen nur anfangs eine relativ geringe Menge von Aktivierungsenergie zuführen muss! |
| Hier geht es zu den Lösungen. | |
möglicherweise neue "Fachbegriffe":
|
Da sie zuerst zugeführt werden muss, wirkt Aktivierungsenergie wie eine Barriere, die ein spontanes Ablaufen einer chemischen Reaktion verhindert. Deshalb kann man die Aktivierungsenergie auch als Hürde und die Höhe der Aktivierungsenergie als die Höhe des zu überwindenden Hindernisses betrachten. Mit Katalysatoren kann man die für chemische Reaktionen erforderlichen Aktivierungsenergien reduzieren. Wurde ein Katalysator von einem Lebewesen hergestellt, dann nennt man ihn auch Biokatalysator oder kurz Enzym. Werden chemische Reaktioen durch Enzyme katalysiert, dann bezeichnet man die Edukte als Substrate.
| Diagramm der Aktivierungsenergie |
|---|
| Das Diagramm zeigt für exotherme chemische Reaktionen den Unterschied zwischen den Aktivierungsenergien mit und ohne Katalysator bzw. Enzym (Biokatalysator). |
Normalerweise besitzen die einzelnen Teilchen eines Stoffes ein breites Spektrum unterschiedlich großer kinetischer Energien, sodaß ein je nach der Höhe der Aktivierungsenergie größerer oder kleinerer Teil der Teilchen über die notwendige Energie verfügt und tatsächlich reagiert. Diesen Anteil reagierender Teilchen und damit auch die Reaktionsgeschwindigkeit kann man steigern oder reduzieren, indem man einem Stoffgemisch Strahlungsenergie oder kinetische Energie in Form von Wärmeenergie zuführt oder entzieht. Diese Hürde Aktivierungsenergie ist umso geringer, je höher während einer chemischen Reaktion die Temperatur der Umgebung ist. Deshalb gilt folgende Reaktionsgeschwindigkeit-Temperatur-Regel:
|
Viele chemische Reaktionen laufen doppelt bis dreimal so schnell ab, wenn man die Reaktionstemperatur um 10°C erhöht. |
| alternatives Diagramm zum Verständnis der Aktivierungsenergie |
|---|
|
|
| Das Diagramm zeigt für zwei verschiedene Temperaturen die Verteilungen der Energien der Teilchen. Die blaue Kurve zeigt, dass bei niedriger Temperatur keine Teilchen die für eine Reaktion erforderliche Energie besitzen. Würde man Aktivierungsenergie zuführen, dann könnte die Verteilung der Energien der Teilchen der grünen Kurve entsprechen. Und dann würden einige Teilchen am rechten Rand des von der grünen Kurve dargestellten Spektrums unterschiedlicher Energieinhalte über genügend Energie für die chemische Reaktion verfügen. |
| Die chemische Reaktion selber kann bei konstantem Druck und Volumen insgesamt Energie verbrauchen (endotherm) (genauer gesagt in chemischen Bindungen speichern) oder auch Energie freisetzen (exotherm). |
| Vergleich exo- und endothermer chemischer Reaktionen |
|---|
| Das Diagramm veranschaulicht den Unterschied zwischen endothermen und exothermen chemischen Reaktionen. Die aufzubringende Aktivierungsenergien hängt vom Energieniveau der Edukte ab und wird durch Katalysatoren bzw. Enzyme (Biokatalysator) stark reduziert. |
Die Aktivierungsenergie wird meist in Kilojoule/mol angegeben. Dies zeigt, dass selbstverständlich die benötigte Aktivierungsenergie mit der Menge der Stoffe zunimmt, die man gleichzeitig aktivieren möchte. Oft ist allerdings die gleichzeitige Aktivierung der gesamten Eduktmenge gar nicht das Ziel. Man muss ja nur einen winzigen Teil eines Stoffes aktivieren, weil sich die einmal in Gang gesetzte chemische Reaktion danach selbst erhält und ausbreitet. Darum braucht man für einen großen Heuballen genau wie für einen kleinen nur ein Streichholz, um ihn anzuzünden.

| Aufgaben zur Erarbeitung des Lernstoffes: | |
|---|---|
| c1 | Erkläre die Notwendigkeit von Enzymen in unseren Zellen! |
| c2 | Benenne die Monomere, aus denen Enzyme aufgebaut sind! |
| c3 | Definiere den Begriff Enzym mit einem Wort und erkläre dessen Bedeutung! |
| c4 | Beschreibe, was während einer chemischen Reaktion mit einem Enzym passiert! |
| c5 | Erkläre mit einer Gleichung den Zusammenhang zwischen Holoenzym, Apoenzym und Cofaktor! |
| c6 | Definiere das aktive Zentrum und erkläre die Substratspezifität eines Enzyms! |
| c7 | Beschreibe die Entstehung eines Enzym-Substrat-Komplexes und was aus ihm wird! |
| c8 | Definiere den Begriff Wirkungsspezifität! |
| Hier geht es zu den Lösungen. | |
möglicherweise neue "Fachbegriffe":
|
Unsere Zellen sind keine feuerfesten Reagenzgläser. Man kann sie nicht einfach erhitzen, um chemische Reaktionen möglich oder schneller zu machen. Damit die unzähligen chemischen Reaktionen in unseren Zellen bei einer Körpertemperatur von 37°C ablaufen können, brauchen wir für fast jede chemische Reaktion ein eigenes Enzym. Manche Enzyme sind RNAs, aber die meisten gehören zu den Proteinen. Die chemischen Reaktionen in unseren Zellen würden prinzipiell auch ohne Enzyme ablaufen, aber mit Enzymen können chemische Reaktionen bis zu 1017 [Stryer, Biochemie 8. Aufl. S. 256] mal schneller ablaufen. Das übertrifft um Größenordnungen die Beschleunigung einer Schnecke auf Lichtgeschwindigkeit.
Besonders wichtig ist das im Verlauf der Evolution perfektionierte aktive Zentrum eines Enzyms. Das ist ein Hohlraum oder dreidimensionaler Spalt, in dem es zu Wechselwirkung zwischen dem Substrat oder Cofaktor und katalytischen Gruppen von Aminosäuren aus teilweise weit entfernten Bereichen der Aminosäurekette kommt. Während die katalytische Wirkung auf der vorübergehenden Bildung von Atombindungen beruhen kann, erfolgt die schwache reversible Bindung des Substrates meistens durch elektrostatische Wechselwirkungen, Wasserstoffbrückenbindungen oder Van-der-Waals-Wechselwirkungen. Weil diese schwachen Wechselwirkungen über keine großen Reichweiten verfügen, müssen aktiven Zentrum und Substrat üblicherweise wie Schloss und Schlüssel zusammen passen (Schlüssel-Schloss-Prinzip). Allerdings sind aktives Zentrum und Substrat nicht starr wie Stahl, sondern passen sich an einander an. Besonders optimierte Enzym können ihre Substrate in ihre aktive Zentren dirigieren (Circe-Effekt) und dort sogar in die richtige Position und Orientierung bringen. Dann verändern das aktive Zentrum und das Substrat ihre räumlichen und/oder chemischen Strukturen so, dass das Substrat die gewünschte chemische Reaktion besser ausführen kann. Die gegenseitige Anpassung der Konformationen von Enzym und Substrat sowie die Verbiegung oder chemische Modifikation des Substrates überführen dieses in einen energiereicheren und reaktionsfreudigeren Übergangszustand. Enzyme stabilisieren selektiv einen bestimmten Übergangszustand und erleichtern dadurch auch nur eine bestimmte chemische Reaktion. Die vielen schwachen Wechselwirkungen zwischen aktivem Zentrum und Substrat setzen Bindungsenergie genannte freie Enthalpie frei, die für die Aktivierung des Substrates bzw. Bildung des energiereicheren Übergangszustandes genutzt werden kann.
| Schema einer Enzym-Substrat-Wechselwirkung |
|---|
| Tim Vickers, Public domain |
|
Nicht nur Enzyme, sondern alle Katalysatoren gehen unverändert aus einer chemischen Reaktion hervor. Nur temporär (vorübergehend) ändern sie während einer chemischen Reaktion ihre Strukturen. Während Enzyme nach den von ihnen katalysierten chemischen Reaktionen ihre ursprünglichen Formen zurückerhalten, reagieren die Substrate zu den Produkten.
Enzyme katalysieren die Hin- und auch die Rückreaktionen, sodass sich Gleichgewichte zwischen Substraten und Produkten einstellen. Das Verhältnis von Substraten und Produkten im Gleichgewicht wird von Enzymen nicht beeinflusst.
|
Nur zum vertieften Verständnis für die aus dem Chemie-Unterricht mit der Thermodynamik vertrauten Lernenden sei ergänzt:
|
|---|

| Aufgaben zur Erarbeitung des Lernstoffes: | |
|---|---|
| d1 | Definiere den Enzym-Substrat-Komplex! |
| d2 | Erkläre den Sättigungseffekt bei Enzym-katalysierten chemischen Reaktionen! |
| Hier geht es zu den Lösungen. | |
möglicherweise neue "Fachbegriffe":
|
Normalerweise steigt bei chemischen Reaktionen die Reaktionsgeschwindigkeit proportional mit der Konzentration der Edukte. Im Gegensatz dazu gibt es bei enzymatisch katalysierten chemischen Reaktionen einen Sättigungs-Effekt. Das liegt daran, dass bei einer enzymatischen chemischen Reaktion die Substrate nicht einfach überall reagieren können. Die Substrate müssen passend orientiert mit geeigneter Geschwindigkeit auf ein freies Enzym treffen und mit diesem einen Enzym-Substrat-Komplex bilden. Mit zunehmender Substrat-Konzentration wird es für die Substrate immer schwieriger, ein freies Enzym zu finden. Der Sättigungs-Effekt zeigt, dass es Zeit kostet, Substrate zu binden, Enzym-Substrat-Komplexe zu bilden, Substrate zu Produkten reagieren zu lassen und die Produkte aus den aktiven Zentren der Enzyme zu entfernen. Während der Bildung eines Enzym-Substrat-Komplexes ändern viele Enzyme ihre spektroskopischen Eigenschaften.
| Diagramm der Sättigungskurve einer Enzym-katalysierten chemischen Reaktion |
|---|

| Aufgaben zur Erarbeitung des Lernstoffes: | |
|---|---|
| d3 | Erkläre Ursachen der Substratspezifität von Enzymen! |
| d4 | Entwickle Hypothesen für mögliche Ursachen der Unterschiedlichkeit der Substratspezifität verschiedener Enzyme! |
| d5 | Erkläre die Stereospezifität der Enzyme! |
| Hier geht es zu den Lösungen. | |
möglicherweise neue "Fachbegriffe":
|
Das direkt an der chemischen Reaktion des Substrates beteiligte aktive Zentrum des Enzyms muss so exakt zur Form des Substrates passen wie ein Schloss zu einem Schlüssel (Schlüssel-Schloss-Prinzip). Nur wenn die Oberfläche des Substrats genau in die Form des aktiven Zentrums des Enzyms passt, kann sich ein Enzym-Substrat-Komplex bilden. Das ist ein Grund für die Substratspezifität. So nennt man die Eigenschaft eines Enzyms, nur ganz bestimmte (nämlich genau passende) Substrate am aktiven Zentrum zu binden und in einen aktivierten Zustand zu versetzen. Für die Substratspezifität sorgen außer der reinen Form auch die funktionellen Gruppe der Aminosäuren (katalytische Gruppen) im aktiven Zentrum. Denn die Verteilung von elektrischen Ladungen und potentiellen Bindungspartnern ist entscheidend für die Wechselwirkungen zwischen Enzym und Substrat. Allerdings ist die Substratspezifität bei verschiedenen Enzymen sehr unterschiedlich ausgeprägt.
Unsere Hände bestehen im Prinzip aus den gleichen Bestandteilen, aber sie unterscheiden sich durch eine spiegelbildliche Anordnung der Finger und anderen Bestandteilen. Obwohl linke und rechte Hand im Prinzip gleich funktionieren, kann eine linke Hand mit einer Rechtshänderschere wenig anfangen. Das gleiche Phänomen gibt es auch bei Molekülen, wo man es Stereoisomerie nennt. Obwohl Stärke und Zellulose beide aus dem Monomer Glucose aufgebaut sind, führen unterschiedliche chemische Bindungen zu unterschiedlichen räumlichen Strukturen und von zwei unterschiedlichen räumlichen Strukturen kann nach dem Schlüssel-Schloss-Prinzip nur eine, also eines der beiden Stereoisomere in das aktive Zentrum eines Enzyms passen. Das nennt man Stereospezifität der Enzyme und das bedeutet, dass die Stereospezifität nur eine Form der Substratspezifität der Enzyme ist.

| Aufgaben zur Erarbeitung des Lernstoffes: | |
|---|---|
| d6 | Erkläre den Zusammenhang zwischen der Tertiärstruktur und der Wirkungsspezifität eines Enzyms! |
| d7 | Nenne Vor- und Nachteile der Wirkungsspezifität von Enzymen! |
| Hier geht es zu den Lösungen. | |
möglicherweise neue "Fachbegriffe":
|
Aus der Konformation des Substrates und der Tertiärstruktur des Enzyms ergibt sich die räumliche Struktur des Enzym-Substrat-Komplexes. Dessen Struktur bedingt eine bestimmte Funktion und das ist in diesem Fall eine ganz bestimmte chemische Reaktion. Das ist die Ursache für die Wirkungsspezifität von Enzymen. Von mehreren oder vielen möglichen chemischen Reaktionen eines Substrates kann jedes Enzym nur eine ganz bestimmte katalysieren. Man könnte die Wirkungsspezifität auch als die Unfähigkeit der Enzyme bezeichnen, unterschiedliche chemische Reaktionen eines Substrates zu verschiedenen Produkten zu katalysieren. Aber tatsächlich ist es ein Vorteil, dass Enzyme nur die erwünschten und keine Nebenprodukte erzeugen.

| Aufgaben zur Erarbeitung des Lernstoffes: | |
|---|---|
| d8 | Erkläre die Notwendigkeit von Cofaktoren! |
| d9 | Beschreibe die Unterschiede zwischen Cosubstraten und prosthetischen Gruppen! |
| Hier geht es zu den Lösungen. | |
möglicherweise neue "Fachbegriffe":
|
Viele Enzyme bestehen nicht nur aus einem Protein, sondern benötigen für ihre Funktion einen zusätzlichen Faktor, den sogenannten Cofaktor oder Kofaktor. Cofaktoren werden benötigt, weil die nur 20 unterschiedlichen Aminosäuren oder 4 verschiedenen Nukleotide eines Enzyms nicht nicht für jede chemischen Reaktion alle funktionelle Gruppen und Atome bereitstellen können, die für die Katalyse benötigt werden. Man bezeichnet so ein zusammengesetztes Enzym als Holoenzym und nennt dessen Protein-Anteil Apoenzym.
| Apoenzym + Cofaktor = Holoenzym |
Als Cofaktor kann ein Metall-Ion dienen oder ein niedermolekulares (kleines) organisches Molekül. Letzteres kann (meistens kovalent) irreversibel an das Enzym gebunden sein. Dann nennt man es prosthetische Gruppe. Der Begriff kommt übrigens von Prothese, also einer Ergänzung eines unvollständigen Körpers. Es kann aber auch reversibel (nicht-kovalent) für nur jeweils eine Enzym-Reaktion (Katalyse) an das Apoenzym gebunden sein. In dem Fall spricht man von einem Coenzym oder besser von einem Cosubstrat, weil es wie das Substrat während der Katalyse verändert wird und sich wieder vom Apoenzym löst (dissoziiert). Cosubstrate können während der chemischen Reaktion eine funktionelle Gruppe, ein Proton oder Elektronen aufnehmen oder abgeben. Im Gegensatz zum Enzym und zur prosthetischen Gruppe geht also ein Cosubstrat verändert bzw. verbraucht aus der chemischen Reaktion hervor. Außerdem sind Cosubstrate im Gegensatz zu Enzymen nicht substratspezifisch, weil sie mit verschiedenen Enzymen zusammen arbeiten können.
|

| Aufgaben zur Erarbeitung des Lernstoffes: | |
|---|---|
| e1 | Definiere die energetische Kopplung! |
| e2 | Erkläre die Notwendigkeit energetischer Kopplungen! |
| e3 | Beschreibe zwei Mechanismen energetischer Kopplungen! |
| Hier geht es zu den Lösungen. | |
möglicherweise neue "Fachbegriffe":
|
Eine energetische Kopplung ist immer dann notwendig, wenn die Produkte einer endothermen chemischen Reaktion energiereicher sind als die Edukte. Solche chemischen Reaktionen laufen nämlich nur unter Zufuhr von Energie ab.
|
|
|
So wird beispielsweise die chemische Energie eines ATP-Moleküls genutzt, um ein Phosphat auf das Edukt Glucose zu übertragen. Dadurch entsteht das energiereichere Zwischenprodukt Glucose-1-Phosphat. Dieses kann dann in einer zweiten chemischen Reaktion mit dem zweiten Edukt Fructose zum Produkt Saccharose reagieren. Übrig bleiben ADP und ein Phosphat, die in einem Mitochondrium wieder zu energiereichem ATP verbunden werden.

| Aufgaben zur Erarbeitung des Lernstoffes: | |
|---|---|
| e4 | Definiere den Fachbegriff ATPase! |
| e5 | Erkläre den eigentlichen Zweck einer ATPase! |
| e6 | Nenne Beispiele für ATPasen, die nicht der Katalyse chemischer Reaktionen dienen! |
| Hier geht es zu den Lösungen. | |
möglicherweise neue "Fachbegriffe":
|
Unsere Zellen enthalten viele Enzyme, die energiereiches ATP in relativ energiearmes ADP und Phosphat zerlegen. Wie man sich denken kann, ist das aber nicht das Ziel dieser ATPasen. Vielmehr liefert die Spaltung von ATP die Energie für zahlreiche wichtige Lebensprozesse in unseren Zellen:
|

| Aufgaben zur Erarbeitung des Lernstoffes: | |
|---|---|
| f1 | Definiere das Temperaturoptimum einer Enzym-Reaktion! |
| f2 | Skizziere eine Kurve zur Darstellung der Enzym-Aktivität in Abhängigkeit von der Temperatur und erkläre den Verlauf der Kurve! |
| f3 | Skizziere und erkläre separate Kurven der Enzym-Aktivität bei einer Rückkehr zum Temperaturoptimum ausgehend von Temperaturen weit unterhalb bzw. oberhalb! |
| f4 | Entwickle ein Experiment zur Ermittlung eines Temperaturoptimums einer Enzym-Reaktion! |
| f5 | Skizziere eine grafische Darstellung der zu erwartenden experimentell gewonnenen Daten! |
| f6 | Entwickle eine Hypothese zur Erklärung eines Nachteils wechselwarmer Tiere hinsichtlich der Evolution ihrer Enzyme! |
| Hier geht es zu den Lösungen. | |
möglicherweise neue "Fachbegriffe":
|
Bis zum Erreichen des Temperaturoptimums steigt mit zunehmender Umgebungs-Temperatur auch die Reaktionsgeschwindigkeit an. Am Temperaturoptimum erreicht die Reaktionsgeschwindigkeit ihr Maximum. Sie steigt also trotz weiter zunehmender Umgebungs-Temperatur nicht weiter an. Bei Temperaturen oberhalb des Temperaturoptimums nimmt die Reaktionsgeschwindigkeit wieder ab.
Soweit scheint die Sache einfach zu sein, bis man das so leicht daher Gesagte in einem Diagramm zu skizzieren versucht. Während nämlich Texte häufig Unwissenheit verschleiern, fällt sie in Zeichnungen bzw. schon beim Zeichnen meistens auf. Folgende Kurvenschar soll das verdeutlichen.
| verschiedene den Text korrekt wiedergebende Kurven |
|---|
| Dieses Diagramm zeigt, wie uneindeutig der Text formuliert ist. Alle diese Kurven geben ihn korrekt wieder, aber nur eine ist wirklich eine typische Darstellung der Temperaturabhängigkeit der Reaktionsgeschwindigkeit eines Enzyms. |
Nun muss man also doch noch einmal darüber nachdenken, welcher der vielen denkbaren Kurvenverläufe korrekt ist.
|
Links vom Temperaturoptimum sind also nur die beiden grünen und die dunkelblaue Kurve korrekt, wobei die blaue oben verdächtig spitz ausläuft. Derart scharf werden Enzyme nicht wirklich auf Temperaturänderungen reagieren. Den beschleunigten Abfall der Reaktionsgeschwindigkeit bei Temperaturen oberhalb des Temperaturoptimums gibt nur die dunkelgrüne Kurve richtig wieder und ist deshalb insgesamt die einzig richtige Grundform, von der die Temperaturkurven verschiedener Enzyme nur in den Feinheiten abweichen. Es gibt allerdings auch Enzyme, die beim Abkühlen von selbst wieder in ihre funktionsfähige Form zurückfinden und dann wieder aktiv sind.
Die in Aufgabe f2 skizzierte Kurve sollte das grafisch darstellen. Statt einem einzigen Diagramm kann man verschiedene Aspekte der Temperaturabhängikeit von Enzymen in separaten Diagrammen und unterschiedlichen Temperatur-Skalen darstellen (siehe Aufgabe 3).
Weil Lebewesen mit nicht optimal arbeitenden Enzymen im Kampf ums Überleben und erfolgreiche Fortpflanzung Nachteile haben, dürften bei Lebewesen mit konstanter Körpertemperatur die Temperaturoptima der allermeisten Enzyme nahe dem oberen Ende der Temperaturen liegen, bei denen sie normalerweise arbeiten müssen. Die Temperaturoptima der meisten menschlichen Enzyme liegen wohl um die 39°C [Universität Ulm - Tierphysiologisches Anfängerpraktikum - Stoffwechselphysiologie - Enzymkinetik Seite 7]. Ich habe allerdings mehr Quellen gefunden, in denen als Temperaturoptimumum 37°C genannt wird [DocCheck Flexikon Temperaturoptimum, Lernhelfer - Enzyme, Temperaturabhängigkeit der Katalaseaktivität]. Viel problematischer ist die evolutionäre Anpassung der Temperaturoptima bei Lebewesen, deren Körpertemperaturen unter dem Einfluss von Strahlungsenergie rasch ansteigen oder einfach den Umgebungstemperaturen folgen. Ihre Enzyme müssen mit einem breiten Temperatur-Spektrum zurechtkommen und können daher kaum für eine Temperatur optimiert werden.
| Bei Lebewesen mit konstanten Körpertemperaturen haben sich die Temperaturoptima ihrer Enzyme evolutionär an ihre Körpertemperaturen angepasst. Wechselwarme Lebewesen haben dafür den Vorteil, erheblich weniger Energie zu verbrauchen. |
Die Temperaturoptima von Enzymen liegen bei Warmblütern und bei Lebewesen in Lebensräumen mit konstanter Temperatur im Bereich der Körpertemperatur. Die liegt bei gesunden Menschen zwischen 36 und 37°C. Die normale Körpertemperatur liegt bei Vögeln tagsüber je nach Vogelart zwischen 38 und 43°C. Nachts lassen viele Vögel ihre Körpertemperatur stark absinken, um Energie zu sparen. Die Vogel-Enzyme müssen an die höhere Körpertemperatur des Tages angepasst sein, denn erstens dürfen sie nicht bei diesen hohen Temperaturen denaturieren und zweitens müssen die meisten Enzyme vor allem dann schnell arbeiten, wenn ein Organismus aktiv ist.
Da sich Milchsäure-Bakterien bei Raumtemperatur sehr schnell vermehren, dürfte das Temperaturoptimum ihrer Enzyme auch in diesem Temperaturbereich liegen. Wenn man das aber wirklich wissen will, dann muss man es experimentell untersuchen (siehe die Aufgaben f4 und f5).

| Aufgaben zur Erarbeitung des Lernstoffes: | |
|---|---|
| f7 | Definiere das pH-Optimum einer Enzym-Reaktion! |
| f8 | Beschreibe Mechanismen der Enzym-Inaktivierung durch pH-Änderungen! |
| f9 | Erkläre die Notwendigkeit unterschiedlicher pH-Optima unserer Enzyme! |
| Hier geht es zu den Lösungen. | |
möglicherweise neue "Fachbegriffe":
|
Der pH-Wert hat ebenfalls einen großen Einfluss auf die Aktivität vieler Enzyme. Denn außer dem Temperaturoptimum haben Enzyme auch ein pH-Optimum, bei dem die Enzymaktivität ein Maximum erreicht. Bei niedrigeren und bei höheren pH-Werten sinkt die Enzymaktivität immer weiter ab.
|
| Diagramm zur pH-Wert-Abhängigkeit von Enzym-Aktivitäten |
|---|
| Dieses Diagramm zeigt, wie unterschiedlich Enzyme auf den pH-Wert reagieren. |
Die allermeisten Enzyme sind Proteine, und die Funktion eines Proteins hängt von seiner Tertiärstruktur, teilweise auch von seiner Quartärstruktur ab. Von den Sekundärstrukturen bis zur Quartärstruktur wird die räumliche Anordnung jeder Aminosäurekette bestimmt durch die chemischen Wechselwirkungen zwischen den sauren, basischen oder neutralen (polaren oder unpolaren) Resten ihrer Aminosäuren. Während die Van-der-Waals-Wechselwirkungen durch hohe Temperaturen destabilisiert werden, beeinflusst der pH-Wert die Ionenbindungen und Wasserstoffbrückenbindungen. Bei hohen pH-Werten entziehen die Hydroxylionen einigen schwach sauren und polaren Aminosäuren Protonen, die dann nicht mehr für Wasserstoffbrückenbindungen zur Verfügung stehen. Ändert sich der pH-Wert, dann ändert sich durch die Aufnahme oder Abgabe von Protonen durch funktionelle Gruppen von Aminosäuren auch die Verteilung der elektrischen Ladungen innerhalb eines Proteins. Dadurch können elektrostatische Bindungen oder Abstoßungen verloren gehen oder neue gebildet werden. Auch diese Effekte von pH-Wert-Änderungen verändern Form (Tertiärstruktur) und Funktion (z.B. Enzym-Aktivität) eines Proteins.
Geringe Veränderungen des pH-Wertes bewirken nur leichte oder nur bei einem kleinen Teil der Enzym-Moleküle Änderungen von Form und Funktion. Größere Änderungen des pH-Wertes ändern mehr elektrostatische Ladungen innerhalb eines Enzyms und beeinträchtigen dadurch stärker seine Form und Funktion bis hin zum Verlust von Tertiärstruktur und Sekundärstrukturen. Bei extrem sauren oder alkalischen pH-Werten können Proteine sogar in Peptide und Aminosäuren zerfallen.
Sicher könnten auch die Organe ihre Strukturen und pH-Werte an die optimalen Arbeitsbedingungen der in ihm aktiven Enzyme anpassen. So muss es möglicherweise im Magen sehr sauer sein, weil seine Enzyme die zu verdauenden Eiweiße nur zerlegen können, wenn diese Eiweiße durch die Säure aufgelockert bzw. denaturiert wurden. Noch wichtiger als die Auflockerung der Proteine könnte aber auch die Bekämpfung gefährlicher Krankheitserreger durch die Magensäure sein. Vielleicht mussten sich deshalb der Magen und seine Enzyme Pepsin und Kathepsin an niedrige pH-Werte anpassen.
Vielleicht konnten sich die Verdauungsenzyme des Dünndarms schon aufgrund ihrer Vielfalt nicht an eine extrem saure Umgebung anpassen. Möglicherweise mussten sie es aber auch nicht, weil spätestens im Dickdarm ein tiefer pH-Wert den für uns lebenswichtigen Bakterien schaden würde. Magensäure würde aber auch dem Dünndarm schaden, weil dieser sich im Gegensatz zum Magen nicht durch ein dicke Schicht Schleim schützen könnte, ohne die Aufnahme der Nährstoff-Monomere zu beeinträchtigen. Jedenfalls liegen die pH-Optima unserer Darm-Enzyme im alkalischen Bereich. Also müssen Bauchspeicheldrüse und Gallenblase stark alkalische Sekrete (Bauchspeichel und Galle) in den Zwölffingerdarm spritzen, damit die Enzyme des Dünndarms arbeiten können.

möglicherweise neue "Fachbegriffe":
|
Viele Enzym-Namen wirken auf den ersten Blick übertrieben kompliziert. Ungeübten erscheinen sie unlernbar und kaum aussprechbar, weil sie die Struktur der Namen sowie die dahinter steckende Logik nicht erkennen. Dabei setzen sich die Namen der Enzyme nach einem einfachen Prinzip zusammen. Nach der internationalen Nomenklatur der Enzyme beginnt der Name eines Enzyms mit dem Namen seines Substrates. Es folgt der Name der vom Enzym katalysierten chemischen Reaktion. Schließlich wird noch die allen Enzymen gemeinsame Endung: "ase" angehängt. So wird beispielsweise das Substrat Malat von der Malatdehydrogenase dehydrogeniert, wobei das "de" für Wegnehmen steht und "Hydrogen" das englische Wort für Wasserstoff (vom lateinischen Hydrogenium) ist.
Fehlt Enzym-Namen die Endung "ase", dann handelt es sich um Trivialnamen. Beispiele dafür sind die Verdauungsenzyme Pepsin, Trypsin und Chymotrypsin. Naturwissenschaftler benutzen außer dem Namen zusätzlich eine Nummer (z.B.: 1.1.1.1 für die Alkohol-Dehydrogenase oder 2.4.1.1 für die Glycogen-Phosphorylase), mit der wir uns in der Schule aber nicht beschäftigen müssen.
Aufgrund ihrer Reaktionstypen werden Enzyme in die 6 Hauptklassen Oxidoreduktasen, Transferasen, Hydrolasen, Lyasen, Isomerasen und Ligasen eingeteilt.

Ein Beipiel für eine Enzym-gesteuerte chemische Reaktion ist die Spaltung des Disaccharids Maltose in zwei Moleküle Glucose durch ein Enzym namens Maltase. Hier bezeichnet man den Ausgangsstoff Maltose chemisch als das Edukt einer chemischen Reaktion. Biochemisch spricht man vom Substrat eines Enzyms, das in diesem Fall Maltase heißt.
| Schema der Maltose | |
|---|---|
| anonymer Neurowissenschaftler, Public domain | |
Als Produkte oder Reaktionsprodukte entlässt die Maltase zwei Glucose-Moleküle. Das Enzym geht am Ende unverändert aus der chemischen Reaktion hervor.
| Schema der Maltase | |
|---|---|
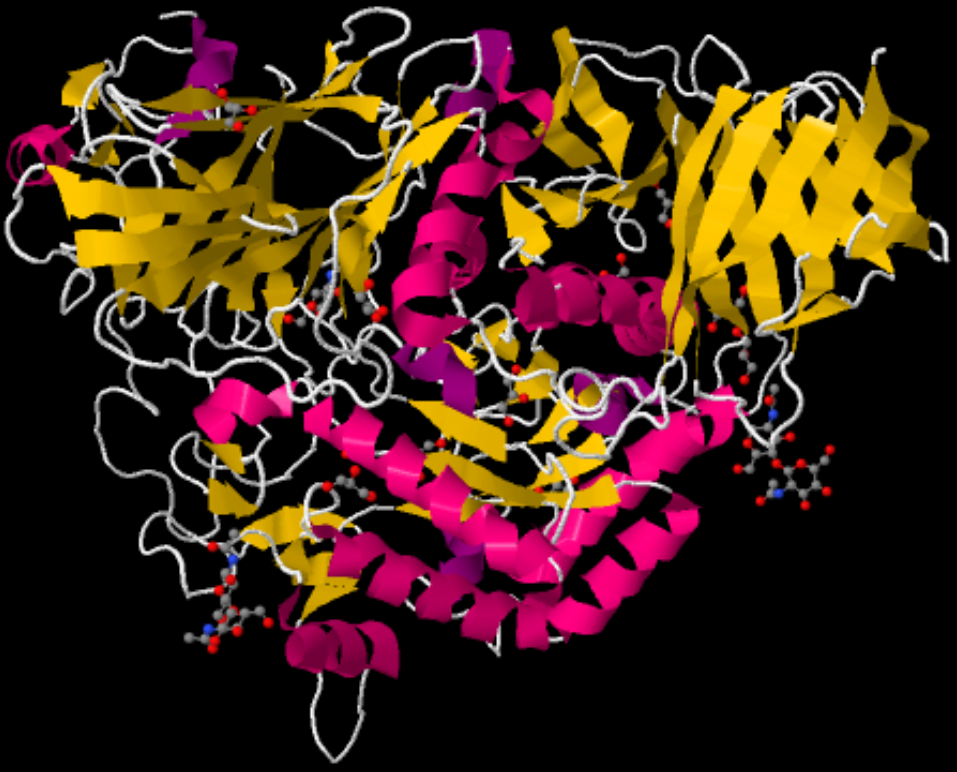 |
|
| Roland Heynkes, CC BY-SA-4.0 (Anklicken des Bildes führt zu einem 3D-Modell.) | |

Homöostase nennen Biologen die Aufrechterhaltung eines Gleichgewichtszustandes bzw. Fließgleichgewichts eines dynamischen offenen Systems durch einen internen regelnden Prozess (Selbstregulation). Lebewesen sind solche Systeme, die beispielsweise ihre Körpertemperaturen oder Konzentrationen von Wasser, Salzen, Gasen oder Nährstoffen in einigermaßen konstanten Fließgleichgewichten halten, indem sie Verbrauch und Zufuhr ausgleichen.
Damit in komplexen Lebewesen die unzähligen Bausteine und Vorgänge wie die Rädchen eines mechanischen Uhrwerks zeitlich und räumlich geordnet ineinander greifen können, benötigen sie möglichst konstante Verhältnisse. Lebewesen versuchen daher, ihre inneren und äußeren Millieus konstant zu halten.
Äußeres Milieu heißt die Umwelt außerhalb eines Lebewesens.
Als inneres Milieu bezeichnet man die unmittelbare Umgebung der Zellen innerhalb des Organismus. (Darum können einzellige Lebewesen kein inneres Milieu haben.) Im inneren Millieu des menschlichen Körpers werden Blut-Volumen, Temperatur, pH-Werte, Salz-, Wasser- und Energiestoffhaushalt (Energiehaushalt) relativ konstant gehalten. Zum Energiestoffhaushalt gehören unter anderem Blutzuckerspiegel und Blutfettwerte.
|
Die Stabilisierung der Faktoren des inneren Milieus eines Lebewesens durch aktive Regulation nennt man Homöostase. |
Der menschliche Organismus ist zu groß, um alle seine Zellen allein durch Diffusion mit Nährstoffen und durch Hautatmung ausreichend mit Sauerstoff zu versorgen. Zur Erhaltung der Homöostase benötigen wir daher auch Lungen, Herz und Adern.
Das vegetative Nervensystem und das Hormonsystem sind die beiden Systeme, welche die Homöostase im menschlichen Körper durch Regulation konstant halten.

|
Das folgende Schema soll nur einen vagen Eindruck von der Komplexität der Stoffwechselkettee einer Zelle vermitteln.
| Schema mit den wichtigsten Stoffwechselwegen einer Zelle im Zusammenhang |
|---|
|
|
| anonym, CC BY-SA 4.0 |
Zellen einzelliger Lebewesen können durch die Evolution ihrer Baupläne die Umsatzgeschwindigkeiten (und Haltbarkeiten) ihrer Enzyme regulieren. Aber auch Eukaryoten passen im Verlauf ihrer evolutionären Entwicklung die Umsatzgeschwindigkeiten ihrer Enzyme nach Möglichkeit an den jeweiligen Bedarf an.
|
Die Wechselzahl eines Enzyms lässt sich experimentell bestimmen, indem man unter für das Enzym optimalen Bedingungen und mit einem Substrat-Überschuss (Sättigung) die durchschnittliche Anzahl der Substrat-Umsätze eines Enzyms pro Zeiteinheit berechnet. Dazu teilt man die in dieser Periode produzierte Produktmenge durch die Anzahl der eingesetzten Enzyme.

|
Ein Beispiel für eine nur bei Bedarf aktivierte Enzym-Produktion ist die Substratinduktion. Dabei fördert das Substrat direkt oder indirekt das Ablesen eines Gens, dessen Genprodukt (Protein) das Enzym ist, welches dann das Substrat verarbeitet. So wird verhindert, dass sich das Substrat zu sehr anreichert. Vor allem aber werden dank dieser Regulation Enzyme nur dann überhaupt produziert, wenn sie tatsächlich genutzt werden können.
Eine andere Möglichkeit ist die Endproduktrepression, wo ein bereits ausreichend produziertes Stoffwechselendprodukt die Proteinbiosynthese eines Enzyms am Anfang einer Kette von Enzym-Reaktionen zur Bildung des Endproduktes unterdückt.
Enzyme können auch bei Bedarf durch Spaltung einer Peptidbindung aus einer inaktiven Vorstufe entstehen.
Zusätzlich werden nicht mehr benötigte Enzyme durch Proteasome abgebaut. Zellen können die Produktion und den Abbau jedes Enzyms regulieren.

| Eine Enzym-gesteuerte chemische Reaktion kann selbst irreversibel oder reversibel sein. Ist sie reversibel, dann kann eine relativ simple Regulation schon darin bestehen, dass die Steigerung der Produkt-Konzentration die Rückreaktion fördert. Wird hingegen das Produkt immer wieder entfernt, dann fördert dies die Hinreaktion. |
Zusätzlich erfolgt jedoch eine direkte Regulation vieler schon bzw. noch vorhandener Enzyme durch Effektoren (Ionen oder kleine Moleküle), welche spezifisch die Geschwindigkeiten bestimmter Enzym-katalysierter chemischer Reaktionen beeinflussen.
|
Man kann die Möglichkeiten der Regulation Enzym-gesteuerter chemischer Reaktionen nach verschiedenen Merkmalen einteilen:
|
Diese unterschiedlichen Merkmale der Regulation von Stoffwechselreaktionen sind vielfältig miteinander kombinierbar. Manche Kombinationen haben bestimmte Namen, die aber nicht immer wirklich eindeutig sind.
Wird beispielsweise eine reversible oder irreversible Stoffwechselreaktion durch einen isosterisch bindenden Inhibitor unvollständig und reversibel inhibiert, dann nennt man das eine kompetitive Hemmung. Weil das Substrat und der Inhibitor um das aktive Zentrum konkurrieren und weil Konkurrenz auf Englisch competition heißt, nennt man den Hemmstoff kompetitiven Inhibitor.
Das folgende Schema soll den Unterschied zwischen isosterischen und allosterischen reversiblen Effektoren veranschaulichen.
| Schema isosterischer und allosterischer Effektoren. |
|---|
| Das Schema zeigt, dass sich isosterische und allosterische Effektoren einfach nur dadurch unterscheiden, dass isosterische am selben Ort und allosterische Effektoren an anderen Bereichen eines Enzyms binden als das Substrat. Die vor- und zurück zeigenden Pfeile deuten an, dass Substrate und Effektoren in diesem Fall reversibel an das Enzym binden und das deshalb Substrat und isosterischer Effektor um die gemeinsame Bindungsstelle konkurrieren (Competition), während allosterische Effektoren weit genug entfernt binden. |
Reversibel am Enzym bindende Substrate und Effektoren können sich sehr unterschiedlich schnell vom Enzym lösen und der Übergang von reversibler und irreversibler Bindung kann fließend sein.
| Schema isosterischer und allosterischer Aktivatoren. |
|---|
| Das Schema zeigt, dass sich isosterische und allosterische Aktivatoren dadurch unterscheiden, dass isosterische am selben Ort und allosterische Aktivatoren an anderen Bereichen eines Enzyms binden als das Substrat. Die vor- und zurück zeigenden Pfeile deuten an, dass Substrate und Aktivatoren in diesem Fall reversibel an das Enzym binden. Allerdings konkurriert jetzt auch der isosterische Aktivator nicht wirklich mit dem Substrat um eine gemeinsame Bindungsstelle, sondern der isosterische und der allosterische Aktivator optimieren die Form des aktiven Zentrums für die Bindung des Substrates oder für dessen chemische Reaktion. |
Ähnlich kann man sich mit dem folgenden Schema die Wirkungen isosterischer und allosterischer Inhibitoren vorstellen.
| Schema isosterischer und allosterischer Inhibitoren. |
|---|
| Das Schema zeigt, dass sich isosterische und allosterische Inhibitoren dadurch unterscheiden, dass isosterische am selben Ort und allosterische Inhibitoren an anderen Bereichen eines Enzyms binden als das Substrat. Die vor- und zurück zeigenden Pfeile deuten an, dass Substrate und Inhibitoren in diesem Fall reversibel an das Enzym binden. Weil der isosterische Inhibitor mit dem Substrat jetzt tatsächlich um die gemeinsame Bindungsstelle konkurriert, kann der isosterische Inhibitor durch einen großen Substrat-Überschuss vom aktiven Zentrum verdrängt werden. Schwieriger ist die Einordnung der im Schema gezeigten allosterischen Hemmung. Denn der allosterische Inhibitor konkurriert nicht (nichtkompetitiv) mit dem Substrat um die Bindung an das aktive Zentrum, kann die Bindung des Substrates an das aktive Zentrum aber dennoch behindern (kompetitive Hemmung). |
Das folgende Schema soll helfen, den Unterschied zwischen kompetitiver und nichtkompetitiver Hemmung zu verstehen.
| Schema kompetitiver und nichtkompetitiver Inhibitoren. |
|---|
| Kompetitive und nichtkompetitive Inhibitoren unterscheiden sich dadurch, dass bei der kompetitiven Hemmung das Substrat und der Inhibitor um die Bindung an das aktive Zentrum des Enzyms konkurrieren (compete, competition), während bei der nichtkompetitiven Hemmung die Bindung des Substrates an das aktive Zentrum des Enzyms durch den Inhibitor überhaupt nicht behindert wird. Nichtkompetitive Inhibitoren behindern nur die Katalyse der chemischen Reaktion. Die vor- und zurück zeigenden Pfeile deuten an, dass Substrate und Inhibitoren in diesem Fall reversibel an das Enzym binden. Weil der kompetitive Inhibitor und das Substrat um die selbe Bindungsstelle konkurrieren, kann kann der hemmende Einfluss kompetitiver Inhibitoren durch einen großen Substrat-Überschuss minimiert werden. Der Einfluss nichtkompetitiver Inhibitoren ist hingegen weitgehend unabhängig von Substrat-Konzentration. |
Das folgende Schema stellt die kompetitive Hemmung etwas ausführlicher dar.
| Schema der kompetitiven Hemmung. |
|---|
| Bei der kompetitiven Hemmung konkurrieren das Substrat und der Inhibitor um die Bindung an das aktive Zentrum des Enzyms. Die vor- und zurück zeigenden Pfeile deuten an, dass das Enzym ständig zwischen diesen drei Zuständen wechselt. |
|
|---|
Das folgende Schema stellt die nichtkompetitiven Hemmung etwas ausführlicher dar.
| Schema der nichtkompetitiven Hemmung |
|---|
| Bei der nichtkompetitiven Hemmung konkurriert der Inhibitor nicht mit dem Substrat. Das bedeutet, dass der Inhibitor die Bindung des Substrates an das aktive Zentrum des Enzyms nicht behindert. Der Inhibitor verändert aber das aktive Zentrum so, dass die Katalyse der chemischen Reaktion behindert wird. Die vor- und zurück zeigenden Pfeile deuten an, dass das Enzym ständig zwischen diesen drei Zuständen wechselt. |
Bis zu den jeweiligen Sättigungskonzentrationen nehmen die Reaktionsgeschwindigkeiten Enzym-katalysierter chemischer Reaktionen zu, wenn die Konzentrationen ihrer Substrate und Coenzyme (falls solche benötigt werden) zunehmen. Die Sättigungskonzentration ist die Substrat-Konzentration, ab der eine weitere Steigerung der Substrat-Konzentrationen nicht mehr zu einer Zunahme der Reaktionsgeschwindigkeit führt, weil bereits jederzeit alle freien Enzym-Makromoleküle ausreichend mit Substrat versorgt sind.
Weil die Bindung des Hemmstoffes an das aktive Zentrum des Enzyms ebenso reversibel wie die des Substrates ist, wird dessen Umsetzung durch das Enzym bei der kompetitiven Hemmung nicht vollständig unterdrückt und kann durch eine Erhöhung der Substrat-Konzentration überwunden werden. Das folgende Diagramm zeigt das mit der blauen Kurve.
| Diagramm der kompetitiven Hemmung |
|---|
| Dieses Diagramm vergleicht für eine Enzym-Reaktion die Reaktionsgeschwindigkeiten ohne Inhibitor und mit reversibler oder irreversibler kompetitiver Hemmung. |
Unterschiedlich wird der Begriff "nichtkompetitive Hemmung" benutzt. Manche verstehen darunter eine irreversible isosterische Bindung eines Inhibitors (Enzymgift), die zu einer irreversiblen Hemmung eines Enzyms führt. Man kann das mit einigem Wohlwollen als gerade noch nicht völlig falsch ansehen, weil das reversibel bindende Substrat einen irreversibel bereits gebundenen Inhibitor nicht mehr vom aktiven Zentrum verdrängen kann. In diesem Sinne erklärt die Wikipedia zwei Möglichkeiten von nichtkompetitivem Antagonismus (Antagonismus ist nicht identisch mit Inhibition, aber vergleichbar.): Als nichtkompetitiver Antagonist wird in der Pharmakologie und Biochemie eine Substanz bezeichnet, die in der Lage ist, die Bindung eines Agonisten an einen Rezeptor zu hemmen, ohne dass diese Substanz durch den Agonisten verdrängt werden kann. Nichtkompetitive Antagonisten können an eine andere (allosterische) Bindungsstelle als der Agonist an den Rezeptor binden. Auch Hemmstoffe der Signalweiterleitung verhalten sich wie nichtkompetitive Antagonisten. Substanzen, die irreversibel an den Rezeptor binden, können ebenfalls einen nichtkompetitiven Antagonismus zeigen.
Wirklich korrekt ist die Erklärung im Falle der Inhibition aber nicht, weil ein Substrat mit den noch nicht gebundenen Inhibitoren sehr wohl konkurrieren kann. So verhindert man die irreversible Inaktivierung eines Enzyms durch einen kovalent bindenden Inhibitor mit Hilfe eines großen Substrat-Überschusses. Die englisch-sprachige Wikipedia betont sogar ausdrücklich, dass JEDER nichtkompetitive Inhibitor an ein allosterisches Zentrum bindet: "all non-competitive inhibitors bind the enzyme at allosteric sites". Auch das allgemein als Standard anerkannte Lehrbuch Stryer Biochemie sagt eindeutig, dass bei einer nichtkompetitiven Hemmung der Inhibitor und das Substrat gleichzeitig an unterschiedlichen Bindungsstellen binden. Tatsächlich wird wird der Begriff "nichtkompetitive Hemmung" viel häufiger auf eine allosterische Inhibitor-Bindung angewendet, weil der Inhibitor und das Substrat nicht um die selbe Bindungsstelle konkurrieren. Nur 5 Absätze später erklärt aber der selbe Wikipedia-Artikel, dass es sehr wohl auch Ausnahmefälle gebe, bei denen auch ein nichtkompetitiver Inhibitor im aktiven Zentrum bindet, ohne allerdings dadurch die Bindung des Substrates zu behindern: "The most common mechanism of non-competitive inhibition involves reversible binding of the inhibitor to an allosteric site, but it is possible for the inhibitor to operate via other means including direct binding to the active site. It differs from competitive inhibition in that the binding of the inhibitor does not prevent binding of substrate, and vice versa, but simply prevents product formation for a limited time.". Diesen Aspekt der nichtkompetitiven Hemmung erklärt ein anderer Wikipedia-Artikel quantitativ: "Non-competitive inhibitors have identical affinities for E and ES (Ki = Ki'). Non-competitive inhibition does not change Km (i.e., it does not affect substrate binding) but decreases Vmax (i.e., inhibitor binding hampers catalysis)." und weiter oben vielleicht verständlicher: "In non-competitive inhibition, the binding of the inhibitor to the enzyme reduces its activity but does not affect the binding of substrate. As a result, the extent of inhibition depends only on the concentration of the inhibitor. Vmax will decrease due to the inability for the reaction to proceed as efficiently, but Km will remain the same as the actual binding of the substrate, by definition, will still function properly.". Entscheidend ist demnach, dass die Bindung des Substrates durch den Inhibitor nicht behindert wird.
In der deutschsprachigen Version dieses Artikels über die Enzymhemmung wird die nichtkompetitive Hemmung zwar genauso definiert, aber da wird daraus gefolgert, dass der Inhibitor nicht am aktiven Zentrum bindet: "Bei der nichtkompetitiven Hemmung wird durch die Bindung des Inhibitors I an das Enzym E die Substratbindung nicht beeinflusst. Der Inhibitor I ist somit in der Lage sowohl an das freie Enzym E als auch an den Enzym-Substrat-Komplex ES zu binden, d. h., der Inhibitor bindet nicht im Substrat bindenden Teil des Enzyms, dem aktiven Zentrum.". Genauso sieht das auch das chemie.de Lexikon. Denn es definiert die nichtkompetitiven Hemmung mit folgenden Worten: Bei der nicht-kompetitiven Hemmung wird durch die Bindung des Inhibitors I an das Enzym E die Substratbindung nicht beeinflusst. Der Inhibitor I ist somit in der Lage sowohl an das freie Enzym E als auch an den Enzym-Substrat-Komplex ES zu binden, d. h. der Inhibitor bindet nicht im Substrat bindenenden Teil des Enzyms, dem aktiven Zentrum. Das Substrat kann mit dem Enzym-Inhibitor-Komplex EI ebenfalls eine Reaktion eingehen, jedoch der gebildete Enzym-Inhibitor-Substrat-Komplex EIS ist nicht in der Lage das Produkt P abzuspalten. Demnach wäre die nichtkompetitive Hemmung ein Spezialfall einer allosterischen Hemmung, denn es gibt auch allosterische Hemmungen, bei denen der allosterisch bindende Inhibitor die Bindung des Substrates hemmt.
Einigkeit gibt es also auch bei der Definition der nichtkompetitiven Hemmung nicht. Wie so oft findet man seriöse Quellen für jede der sich widersprechenden Positionen. Allerdings ist doch die differenzierteste Darstellung meistens die richtigste. Daher tendiere ich zu der Ansicht, dass es in Ausnahmefällen auch irreversible und irreversible nichtkompetitive Inhibitoren gibt, die nur die Reaktionsgeschwindigkeit beeinträchtigen, nicht aber die Bindung des Substrates.
Das Diagramm der kompetitiven Hemmung zeigt rot auch die Wirkung eines irreversibel kompetitiv bindenden Inhibitors. Wenn der kompetitive Inhibitor irreversibel am aktiven Zentrum bindet, dann reduziert er die Anzahl der aktiven Enzym-Moleküle und damit auch die maximal erreichbare Reaktionsgeschwindigkeit, die deshalb früher erreicht wird. In einer Zelle würden allerdings neue Enzym-Moleküle produziert. Dadurch könnte während des Experimentes die maximal erreichbare Reaktionsgeschwindigkeit kontinuierlich zunehmen und die Kurve läge insgesamt etwas höher.
Allosterische Regulation nennen Biologen die Regulation einer Enzym-Aktivität durch die Bindung eines meist kleinen Effektor-Moleküls an einer anderen Stelle (dem regulativen oder allosterischen Zentrum) als dem aktiven Zentrum eines allosterischen Enzyms. Eine allosterische Regulation kann reversibel oder irreversibel, inhibierend oder aktivierend sowie kompetitiv, nichtkompetitiv oder unkompetitiv wirken. Kompetitiv wirkt sie, wenn die Bindung des Substrates am aktiven Zentrum die Bindung des Effektors am allosterischen Zentrum behindert und umgekehrt. Nicht-kompetitiv ist eine allosterische Regulation, wenn die Bindung an dem einen durch eine Bindung am anderen Zentrum nicht beeinflusst wird und die Aktivierung oder Inhibition auf andere Weise erfolgt. Unkompetitiv nennt man eine allosterische Regulation, wenn der Effektor nur an den Enzym-Substrat-Komplex bindet.
| Quartärstruktur einer Phosphofructokinase (Datenbanknummer 3O8O) | |
|---|---|
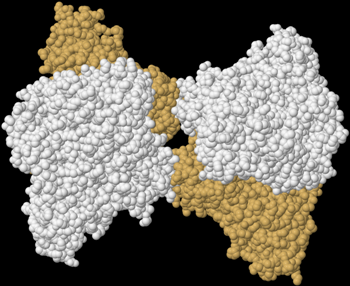 |
Wie komplex die Regulation eines Enzyms sein kann, zeigt das Beispiel der Phosphofructokinase 1 (Fructose-6-phosphat-kinase, EC2.7.1.11), welche beispielsweise in menschlichen Muskelzellen am Beginn der Glykolyse die Glucose-6-phosphat mit ATP zu Fructose-1,6-bisphosphat und ADP reagieren lässt. Dieses kooperative Tetramere bildende Enzym kann durch die allosterische Bindung von ATP, NADH, Zitronensäure, Fructose-2,6-bisphosphat und Fructose-1,6-diphosphat inhibiert sowie durch ADP, AMP, cAMP, ortho-Phosphat und Sulphat allosterisch aktiviert werden, wobei AMP und ATP um ihre Bindungsstelle am regulatorischen bzw. allosterischen Zentrum konkurrieren. Außerdem wird dieses Enzym durch niedrige pH-Werte gehemmt, zu denen es beispielsweise durch die Bildung von Milchsäure kommen kann. |
| Das von mir mit Hilfe der Daten der internationalen Protein Data Bank und dem Programm Jmol erzeugte Bild zeigt einen Enzym-Komplex aus 4 Phosphofructokinase-Molekülen der Backhefe Saccharomyces cerevisiae. | |
Oft wirkt ein Produkt eines der letzten als Inhibitor eines der ersten Enzyme eines Stoffwechselweges. So wird automatisch und effizient verhindert, dass zuviel produziert wird. Zum Beispiel hemmen im Stoffwechselweg aus Glykolyse, Citratzyklus und Atmungskette das Zwischenprodukt Zitronensäure und das Endprodukt ATP ihre Nachlieferung durch eine Inaktivierung der Phosphofructokinase 1. Das selbe Enzym kann aber auch durch die Substrate ADP und Phosphat aktiviert werden, die durch die Spaltung des Produktes ATP von Glykolyse, Zitratzyklus und Atmungskette entstehen.
Bei der allosterischen Endprodukthemmung wirkt das Endprodukt einer Reihe von Enzym-Aktivitäten als allosterischer Hemmstoff für ein Enzym am Anfang der Kette. Das ein Produkt seine eigene Produktion hemmt, verhindert eine Überproduktion. Hemmt ein Stoffwechselendprodukt ein Enzym am Anfang des seiner Produktion dienenden Stoffwechselweges, dann verhindert es die überflüssige Produktion von Zwischenprodukten.
Substrate können ihre eigene Verarbeitung durch ein Enzym auch fördern, indem sie als allosterische Aktivatoren auf dieses Enzym einwirken.


Statt lebender Mikroorganismen werden heute oft isolierte Enzyme in der Lebensmittelverarbeitung, Pharmaindustrie, Chemie sowie beim Spülen und Waschen eingesetzt. So lässt sich die Wirkung besser kontrollieren und ein einzelnes Enzym kann leichter als ein ganzer Organismus an extreme Reaktionsbedingungen angepasst werden. Dabei kann die Gentechnik helfen, Enzyme zu optimieren und sie relativ sauber in Bakterien zu produzieren, anstatt sie aus ekligen oder potentiell gefährlichen, tierischen Geweben zu isolieren. Ein weiterer Vorteil gentechnisch hergestellter Enzyme ist, dass man deren Eigenschaften mit Hilfe der Gentechnik verändern und ungeachtet tierischer Bedürfnisse viel leichter als ganze Zellen für bestimmte Einsatzfelder optimieren und genau an technische und menschliche Bedürfnisse anpassen kann. Andererseits birgt diese Chance auch das Risiko, dabei versehentlich gefährliche Eigenschaften zu erhalten und diese bei ungenügenden Tests nicht rechtzeitig zu erkennen.
Heute werden massenhaft Genome verschiedenster Mikroorganismen sequenziert und darin nach Bauplänen für nutzbare Enzyme gesucht. Vielversprechende Kandidaten können dann noch gentechnisch optimiert werden. Mit solchen Enzymen möchte man auch Aromastoffe und andere sekundäre Pflanzenstoffe produzieren, die vielleicht als Nahrungsmittelzusätze gesundheitsfördernde Wirkungen haben könnten. Für die Massenproduktion können nicht nur die Baupläne der Enzyme, sondern auch die produzierenden Mikroorganismen durch die gezielte Veränderung vieler Gene angepasst werden. Damit solche Mikroorganismen nicht in die freie Natur entkommen und dort Schäden anrichten können, versucht man Mikroorganismen zu züchten, denen wichtige Gene fehlen, sodass sie nur in speziellen Nährlösungen überleben können. Noch radikaler ist der Ansatz, kleinstmögliche Genome komplett synthetisch herzustellen und auszuprobieren, ob sie als Rezeptbuch für ein Minimal-Lebewesen ausreichen.

Die Substratspezifität bewirkt, dass ein Enzym von den vielen Substanzen im komplexen Gemisch Blut nur eine bindet. Die Wirkungsspezifität führt dazu, dass man mit einem passenden Enzym dessen Substrat bzw. die zu untersuchende Substanz in genau ein Produkt umwandeln kann, welches sich qualitativ oder sogar quantitativ nachweisen lässt.
Die Ursache vieler gefährlicher Folgen einer noch nicht erkannten oder nicht gut behandelten Zuckerkrankheit ist die erhöhte Glucose-Konzentration im Blut der Betroffenen, denn dadurch werden die Blutgefäße geschädigt. (Am stärksten wirkt sich das in den Kapillaren aus, weil sie so dünn sind. Besonders betroffen sind daher von vielen Kapillaren durchblutete Organe wie Augen und Nieren sowie besonders empfindlich auf Sauerstoffmangel reagierende Zellen wie Nervenzellen.)
Das Enzym Glucoseoxidase katalysiert die Oxidation von Glucose. Weil diese chemische Reaktion nicht einfach direkt nachgewiesen werden kann, lässt man eine zweite Reaktion folgen, deren Nebenprodukt sich mit einem Indikator nachweisen läss. Unser Buch beschreibt das mißverständlich so, als ob erst durch die zweite chemische Reaktion H2O2 entstünde. Eine grafische Darstellung auf der selben Buchseite zeigt aber, dass H2O2 schon bei der ersten Reaktion entsteht. Demnach verwandelt sich die α-D-Glucose von alleine durch eine reversible Umlagerung in β-D-Glucose, welche durch die Glucosereduktase zu D-Glucono-delta-lacton oxidiert wird. Dabei entsteht das H2O2. Das Enzym Peroxidase katalysiert dann die zweite chemische Reaktion, in welcher das H2O2 einen reduzierten hellblauen Farbstoff zu einem gelb-braunen Farbstoff oxidiert. Dabei wird aus dem H2O2 Wasser. Praktischerweise lassen sich alle benötigten Reagenzien für beide Reaktionen getrocknet auf einen Teststreifen aufbringen, auf den man einen Tropfen Blut gibt. Je nach der Konzentration der Glucose färbt sich daraufhin der Teststreifen mehr oder weniger stark. Die Glucose-Konzentration lässt sich dann durch Vergleich mit einer Farbskala oder mit Hilfe eines Fotometers bestimmen. (Leider nennt unser Buch den Namen des Farbstoffes nicht, aber eine andere Quelle bestätigt den Farbumschlag, während der Chemie, Biologie und Informatik-Lehrer Dr. Kay-Uwe Jagemann und das Buch: "Qualitätssicherung im Medizinischen Laboratorium" andere Farbumschläge beschreiben.)
Ein Bluttest zum Nachweis von Leberschäden könnte auf einer Farbreaktion beruhen, welche durch das von sterbenden Leberzellen freigesetzte Enzym Alanin-Amino-Transferase katalysiert.
Eine erhöhte Konzentration des Creatinkinase-Isoenzyms CK2 im Blut kann durch das Absterben von Herzmuskelzellen verursacht werden. Es kann dafür aber auch andere Ursachen wie Mutationen geben.

| Energie kann weder erschaffen noch vernichtet werden. Es wird immer nur eine Energieform in eine andere umgewandelt. Dabei entsteht immer auch Wärmeenergie, die dann oft nicht mehr nutzbar ist. Die Wärme wird an die Umwelt abgegeben, wo sie die Unordnung (Entropie) vergrößert. |
Mit der Wärmeenergie verlieren Zellen für sie nutzbare Energie, wenn sie durch energetisch nicht begünstigte (endergone) chemische Reaktionen die Ordnung vergrößern (lokal die Entropie reduzieren), indem sie Aminosäuren mit Peptidbindungen zu Proteinen verknüpfen. Nach dem zweiten Hauptsatz der Thermodynamik können chemische Reaktionen in einem thermodynamischen System wie einer Zelle nur dann die Ordnung vergrößern, wenn gleichzeitig in ihrer Umgebung die Unordnung (Entropie) mindestens im gleichen Maße zunimmt. Komplexität ist eine Form von Ordnung. Ohne den ordnenden Einfluss der Lebewesen nimmt aber in der unbelebten Natur immer die Unordnung (Entropie) zu.
| Lebewesen müssen Energie aufwenden, um auf Kosten zunehmender Entropie in ihrer Umwelt die Ordnung im Inneren ihrer Zellen immer wieder zu erneuern, indem sie ständig neue Biomoleküle synthetisieren und größere Strukturen wie Membranen und Protein-Komplexe aufbauen. Darum müssen lebende Zellen ihren Energieverlust ständig durch die Aufnahme von Energie aus der Umwelt ausgleichen. |
Es folgen einige Beispiele für Energieumwandlungen:
|
Pflanzliche Zellen gewinnen ihre chemische Energie durch Umwandlung von Strahlungsenergie. Fotosynthese nennt man den Lebensprozess, in dem pflanzliche Zellen Strahlungsenergie nutzen, um aus Wasser (H2O) und Kohlenstoffdioxid (CO2) Glucose (C6H12O6) und Sauerstoff (O2) zu produzieren. Lebende tierische und pilzliche Zellen müssen energiereiche Stoffe aufnehmen, um aus diesen Energie für ihre Lebensprozesse zu gewinnen. |
| Alle Lebenden Zellen brauchen außerdem Baustoffe für Wachstum und Erneuerung. Darum gelten alle lebenden Lebewesen und Zellen als offene Systeme. Lebende Zellen und andere offene Systeme zeichnen sich dadurch aus, dass sie ständig Energie und Stoffe mit ihren Umgebungen austauschen. Zellen tun das in Form von Fließgleichgewichten, weil sie ungefähr ebenso viel Energie und Materie abgeben, wie sie im selben Zeitraum aufnehmen. |
Überhaupt keinen Stoffwechsel haben die Zellen in flüssigem Stickstoff gelagerter menschlicher Embryonen und andere Lebewesen, die gerade eine Pause vom Leben machen. Sie sind geschlossene Systeme, denn einen Austausch von Energie mit ihren Umwelten können auch sie nicht verhindern.
| Glucose ist ein Grundbaustein der in menschlichen Zellen nur zur Energiegewinnung genutzten Kohlenhydrate. Aminosäuren sind die Grundbausteine der Proteine, die der menschliche Organismus nur im Notfall zur Energiegewinnung nutzt. Wir zerlegen pflanzliche, pilzliche und tierische Proteine in Aminosäuren, um dann daraus unsere eigenen Proteine zu synthetisieren. |

Den Zusammenhang zwischen den beiden extrem wichtigen biologischen Prozessen Fotosynthese und Zellatmung erklärt der Lerntext Fotosynthese und Zellatmung.

Äußere Atmung heißt die Aufnahme von Sauerstoff mit Hilfe der Lunge und des Blutkreislaufes. Sie dient der Versorgung unserer Zellen mit Sauerstoff für die Kette chemischer Reaktionen der Inneren Atmung. Die äußere Atmung dient außerdem der Entsorgung des bei der Zellatmung entstehenden Kohlenstoffdioxids (CO2) durch Blutkreislauf und Lunge.
Bei der Verbrennung (vollständigen Oxidation mit Sauerstoff) in einem Kalorimeter sind die energiereiche Glucose und Sauerstoff die Edukte. Kohlenstoffdioxid und Wasser sind die energiearmen und deshalb sehr stabilen Produkte. Vor der Oxidation haben die wenig elektronegativen Kohlenstoff- und Wasserstoff-Atome größere Anteile an ihren Bindungselektronenpaaren. Nach der Oxidation ziehen die Sauerstoff-Atome aufgrund ihrer großen Elektronegativität die Bindungselektronenpaare stärker zu sich hin und verursachen positivere Ladungen an den Kohlenstoff- und Wasserstoff-Atomen. In diesem Zustand nennt man die Kohlenstoff- und Wasserstoff-Atome oxidiert.
In Zellen erfolgt der Abbau (die Oxidation) der Glucose in zahlreichen Teilschritten und die chemische Energie wird in kleinen Portionen freigesetzt.
Den Abbau der Glucose in unseren Zellen kann man in vier Abschnitte unterteilen:
Leber- und Muskelzellen haben einen relativ hohen Energiebedarf. Deshalb brauchen sie besonders viele Mitochondrien, die als Kraftwerke der Zellen gelten, weil in ihnen die wichtigsten Schritte des Glucose-Abbaus und der damit verbundenen Produktion von ATP stattfinden. Die Glykolyse erfolgt allerdings im Zytoplasma.

Während NADH+H+ zu NAD+ oxidiert wird, wird gleichzeitig bei Sauerstoffmangel in der Milchsäure-Gärung Brenztraubensäure zu Milchsäure reduziert.

In der Glykolyse finden zwei verschiedene energetische Kopplungen statt, bei denen jeweils ein ATP-Molekül den Energietransport von einer chemische Energie liefernden zu einer chemische Energie benötigenden chemischen Reaktion übernimmt. Die chemische Energie liefernden chemischen Reaktionen in der zweiten Hälfte der Glykolyse sind:
Die chemische Energie verbrauchenden und deshalb nur mit Hilfe des energiereichen ATP möglichen chemischen Reaktionen in der ersten Hälfte der Glykolyse sind:
Die energetischen Kopplungen funktionieren so, dass im ersten Schritt katalysiert durch die Enzyme Phosphoglycerinsäurekinase und Brenztraubensäurekinase jeweils ein Phosphatrest und mit ihm die energiereiche Atombindung von den energiereichen Substraten Glycerinsäure-1,3-bisphosphat und Phosphoenolbrenztraubensäure auf ADP übertragen werden, um energiereiches ATP zu bilden. Anschließend wird jeweils in einem zweiten Schritt durch die Enzyme Hexokinase bzw. Phosphofructokinase der Phosphatrest mit der energiereiche Atombindung von ATP auf die energieärmeren Substrate Glucose bzw. Fruchtose-6-Phosphat übertragen. Diese beiden Aktivierungsschritte liefern den Produkten Glucose-6-phosphat und Fructose-1,6-bisphosphat die chemische Energie für die jeweils folgenden chemischen Reaktionen.
|
Glykolyse nennt man in der Biochemie einen zentralen Stoffwechselweg im Energiestoffwechsel und den zentralen Prozess beim Abbau aller Kohlenhydrate in allen Eukaryoten. Selbst unter Bakterien und Archaeen ist die Glykolyse weit verbreitet. In 10 hintereinander geschalteten Stoffwechselreaktionen wird das Monosaccharid Traubenzucker (Glucose) zur doppelten Anzahl von Pyruvat-Molekülen abgebaut. Dabei werden insgesamt jeweils 2 Moleküle ATP und NADH gewonnen.
Vertiefende Informationen über die Glykolyse findet man auf einer Seite der Uni Düsseldorf. |
|
| Diese Darstellung der Glykolyse habe ich auf der Grundlage eines anonym unter der Lizenz Creative Commons Attribution-Share Alike 3.0 der Wikimedia Commons zur Verfügung gestellten Schemas erstellt, um meine Schüler nicht mit anderen Namen zu verwirren und um ein im ursprünglichen Schema fehlendes Detail zu ergänzen. | |
Während im Verlauf der Glykolyse Glycerinaldehyd-3-phosphat zu Glycerinsäure-1,3-bisphosphat oxidiert wird, wird gleichzeitig Nicotinamid-adenin-dinucleotid (NAD+) zu NADH+H+ reduziert.

Ausdauersportler benötigen für ihren Sport hauptsächlich Kohlenhydrate, weil sie während der Ausübung ihrer Sportarten viel Energie verbrauchen, anschließend jedoch kaum Muskeln aufbauen. Mit der Zuführung reiner Glucose sollten Ausdauersportler jedoch vorsichtig sein, weil zu hohe Glucose-Konzentrationen im Blut den Blutgefäßen schaden und deshalb die Ausschüttung größerer Mengen Insulin provozieren, wodurch als überschießende Reaktion die Konzentration der Glucose im Blut sogar unter das Normalniveau fallen und die Leistungsfähigkeit reduzieren kann.
Kraftsportler brauchen besonders viel Eiweiß bzw. Aminosäuren, weil Muskeln nach kurzen, intensiven Belastungen bis zur völligen Erschöpfung Aminosäuren für den Aufbau neuer Proteine brauchen, um sich durch Wachstum an langsam zunehmende Anforderungen anzupassen.
Die Glykolyse findet im Cytoplasma einer Zelle statt. Zehn unterschiedliche, zu einem Stoffwechselweg hintereinander geschaltetete Enzyme katalysieren die chemischen Reaktionen, durch welche ein Glucose-Molekül zu zwei Molekülen Brenztraubensäure im Gleichgewicht mit ihrem Anion Pyruvat abgebaut wird.
Das erste Substrat des Stoffwechselweges Glykolyse wird durch das Enzym Hexokinase praktisch irreversibel phosphoryliert, sodass als energiereicheres Produkt Glucose-6-phosphat entsteht. Die dafür erforderliche Energie wird durch eine energetische Kopplung aufgebracht, indem gleichzeitig das energiereiche Adenosintriphosphat zu ADP und Phosphat gespalten und die Phosphatgruppe auf die Glucose übertragen wird. Das Produktion D-Glucose-6-Phosphat hemmt die Aktivität der Hexokinase und damit seine eigene Produktion.
Die als erstes Enzym der Glykolyse aktive Hexokinase phosphoryliert nicht nur Glucose, sondern verschiedene Einfachzucker (Monosaccharide) wie Mannose und Fructose, die ebenfalls aus 6 C-Atomen bestehen. Die Hexokinasen der Säugetiere phosphorylieren auch sowohl die α- als auch die β-Form der Glucose. Sie besitzt aber eine größere Affinität zur α-D-Glucose. Dafür ist die Konzentration der β-D-Glucose im Gleichgewicht wässriger Lösungen etwa doppelt so groß. Das folgende Schema zeigt es nicht, aber das eigentliche Substrat der Hexokinase ist nicht ATP, sondern ATP2- verbunden mit Mg2+ oder Mn2+.
Das Enzym Phosphoglucoseisomerase wandelt Glucose-6-phosphat reversibel zu Fructose-6-phosphat um. Das bedeutet, dass die Phosphoglucose-Isomerase spezifisch für beide Substrate Glucose-6-phosphat und Fructose-6-phosphat ist. Meine alten Biochemie-Lehrbücher stellen die chemische Reaktion mal mit den α- und mal mit den β-D-Formen von Glucose-6-phosphat und Fructose-6-phosphat dar. Die Phosphoglucose-Isomerase scheint also zwischen beiden Formen nicht zu unterscheiden.
Anschließend erfolgt der zweite Aktivierungsschritt: Das Enzym Phosphofructokinase katalysiert die zweite energetische Kopplung, in welcher die Phosphatgruppe von Adenosintriphosphat auf das Substrat Fructose-6-phosphat übertragen wird und das Produkt Fructose-1,6-bisphosphat entsteht.
Im vierten Schritt der Glykolyse spaltet das Enzym Fructose-bisphosphat-Aldolase die D-Fructose-1,6-bisphosphat reversibel in die beiden Moleküle D-Glycerinaldehyd-3-phosphat und Dihydroxyaceton-phosphat.
Im fünften Schritt der Glykolyse wandelt das Enzym Triosephosphat-Isomerase Dihydroxyacetonphosphat reversibel in Glycerinaldehyd-3-phosphat um.
Im sechsten Schritt der Glykolyse wandelt das Enzym Glycerinaldehyd-3-phosphatdehydrogenase praktisch irreversibel Glycerinaldehyd-3-phosphat in Glycerinsäure-1,3-bisphosphat um und reduziert dabei NAD+ zu NADH. Die durch das Enzym Glycerinaldehyd-3-phosphatdehydrogenase katalysierte stark exotherme Oxidation der Aldehydgruppe des Substrates Glycerinaldehyd-3-phosphat zur Carboxylgruppe des Produktes Glycerinsäure-1,3-bisphosphat ermöglicht durch energetische Kopplung die Phosphorylierung der Carboxygruppe durch anorganisches Phosphat sowie die Reduzierung von NAD+ zu NADH+H+.
Das verglichen mit NAD+ reduzierte und energiereichere NADH aus der Glykolyse dient in der Atmungskette als energielieferndes Coenzym bei der Synthese von ATP. Im folgenden siebten Schritt der Glykolyse überträgt das Enzym Phosphoglyceratkinase eine Phosphatgruppe von Glycerinsäure-1,3-bisphosphat auf ADP und umgekehrt (reversibel) von ATP auf Glycerinsäure-3-phosphat.
Der achte Schritt der Glykolyse ist die reversible Umlagerung der Phosphatgruppe vom dritten C-Atom von Glycerinsäure-3-phosphat zum zweiten C-Atom von Glycerinsäure-2-phosphat durch das Enzym Phosphoglyceratmutase.
Der neunte Schritt der Glykolyse ist die reversible Abspaltung eines Wasser-Moleküls von Glycerinsäure-2-phosphat durch das Enzym Enolase. Es entstehen ein Molekül Wasser und Phosphoenolpyruvat (Phosphoenolbrenztraubensäure).
Der zehnte und letzte Schritt der Glykolyse ist die reversible Übertragung der Phosphatgruppe von Phosphoenolpyruvat auf ADP durch das Enzym Pyruvatkinase. Es entstehen ATP und Pyruvat.
Im Verlauf der Glykolyse entstehen 4 Moleküle Adenosintriphosphat, während nur 2 Moleküle Adenosintriphosphat verbraucht werden, weil nur 1 Molekül Glucose durch den Einsatz von 2 Molekülen Adenosintriphosphat in zwei Schritten aktiviert werden muss, während im weiteren Verlauf 2 Moleküle Glycerinaldehyd-3-phophat entstehen, deren Abbau zu Brenztraubensäure jeweils 2 Moleküle Adenosintriphosphat liefert.
Das Endprodukt der Glykolyse Brenztraubensäure dient unter aeroben Bedingungen als erstes Substrat des Zitronensäurezyklus. Unter anaeroben Bedingungen kann es durch alkoholische Gärung oder durch Milchsäure-Gärung abgebaut werden.
Die Glykolyse muss reguliert werden, damit nicht mehr Adenosintriphosphat gebildet wird, als die Zelle benötigt. Das Enzym Phosphofructokinase eignet sich relativ gut als Schlüsselenzym, weil es das dritte von 10 Enzymen des Stoffwechselweges Glykolyse ist. Die Regulation funktioniert so, dass das Endprodukt Adenosintriphosphat als allosterischer Inhibitor die Aktivität des Schlüsselenzyms Phosphofructokinase durch Reduktion seiner Affinität zum Substrat hemmt, während die Phosphofructokinase durch den allosterischen Aktivator ADP und durch das Substrat Fructose-6-phosphat aktiviert wird.
| Schema der Phosphofructosekinase mit gebundenen ATP-Molekülen (4XYJ) | |
|---|---|
 |
|
| Roland Heynkes, CC BY-SA-4.0 (Anklicken des Bildes führt zu einem 3D-Modell.) | |

Oxidative Decarboxylierung heißt allgemein eine chemische Reaktion, bei der eine Carboxygruppe (-COOH) einer Carbonsäure als Kohlenstoffdioxid (CO2) abgespalten und das restliche Molekül oxidiert wird. So entsteht der größte Teil des von Lebewesen produzierten Kohlenstoffdioxids. Unterschiedliche Enzyme bzw. Enzym-Komplexe katalysieren bei der Zellatmung die oxidativen Decarboxylierungen der Substrate Pyruvat aus der Glykolyse sowie Isocitrat und a-Ketoglutarat im Citratzyklus. Oxidative Decarboxylierung verbindet Glykolyse und Citratzyklus. Sie wird katalysiert von einem der größten bekannten Multienzym-Komplexe, dem Pyruvatdehydrogenase-Komplex. Man findet ihn im Cytoplasma aerober Bakterien und in der mitochondrialen Matrix aerober Eukaryoten, bei Pflanzen zusätzlich in Plastiden. Er besteht aus Dutzenden Kopien von drei unterschiedlichen Untereinheiten, von denen jede eine Teilreaktion katalysiert: Pyruvatdehydrogenasen (E1), Dihydrolipoyl-Transacetylasen (E2) und Dihydrolipoyl-Dehydrogenasen (E3). Als Coenzyme werden Thiaminpyrophosphat, Coenzym A und NAD+, als prosthetische Gruppen FAD und Liponsäure benötigt.
Die oxidative Decarboxylierung spaltet von der Brenztraubensäure (Pyruvat) praktisch irreversibel ein Molekül CO2 ab und die dabei freiwerdende chemische Energie wird genutzt, um die übrigbleibende Acetylgruppe über eine energiereiche Thioesterbindung an das Coenzym A (CoA) zu binden. So entsteht Acetyl-CoA, welches dann im Zitronensäurezyklus chemische Energie liefert. Die Oxidation der Carboxylgruppe der Brenztraubensäure zu CO2 ist dabei gekoppelt mit der Reduktion von NAD+ zu NADH+H+.
Insgesamt ergibt sich für die oxidative Decarboxylierung von Pyruvat folgende Bilanz:
Pyruvat + HS-CoenzymA + NAD+ -> Acetyl-CoenzymA + CO2 + NADH+H+
Zum besseren Verständnis folgt der Ablauf der oxidativen Decarboxylierung von Pyruvat in Schritten laut Wikipedia:
 |
| anonym, Public domain |
| In diesem allgemeinen Schema der oxidativen Decarboxylierung ist R = H, wenn das rote Substrat Pyruvat ist. Beim Substrat a-Ketoglutarat wäre R = CH2-CH2-COO-. Im Schema sind Thiaminpyrophosphat (TPP) und Liponamid nur ausschnittsweise dargestellt. |

Der Abbau der Brenztraubensäure (Pyruvat) durch oxidative Decarboxylierung und den Zitronensäurezyklus findet unter aeroben Bedingungen statt, also bei ausreichender Sauerstoffversorgung. Der erste Schritt des Abbaus der Brenztraubensäure ist die oxidative Decarboxylierung. Sie findet im Cytoplasma aerober Bakterien und in der mitochondrialen Matrix aerober Eukaryoten, bei Pflanzen zusätzlich in Plastiden statt. Danach folgt der Zitratzyklus am selben Ort.
Während Acetyl-CoA im Zitratzyklus nur abgebaut wird, können bei Bedarf mit Substraten bzw. Produkten des Zitratzyklus der Aufbau der Aminosäuren Arginin, Asparagin, Asparaginsäure, Glutamin, Histidin, Isoleucin, Methionin, Phenylalanin, Prolin, Threonin, Tyrosin und Valin sowie von Porphyrinen wie Chlorophyll und Hämoglobin beginnen oder deren Abbau enden. Abbau und Aufbau von Fettsäuren und den Aminosäuren Alanin, Cystein, Glycin, Leucin, Serin und Tryptophan sind genau wie Auf- und Abbau von Glucose nur indirekt über Brenztraubensäure bzw. Acetyl-CoA mit dem Zitratzyklus verbunden.
Vom Pyruvat wird eines seiner 3 C-Atome in Form von CO2 abgespalten. Dabei wird das Kohlenstoff-Atom oxidiert. Wie bei Redoxreaktionen üblich ist die Oxidation des C-Atoms verbunden mit einer Reduktionsreaktion. Und reduziert wird in diesem Fall NAD+ zu NADH. Man nennt diesen gesamten Vorgang oxidative Decarboxylierung. Der vom Pyruvat übrigbleibende Acetyl-Rest wird an das Coenzym A gebunden. Das ist ein Aktivierungsschritt und man nennt das Produkt Acetyl-CoA auch aktivierte Essigsäure. Das Acetyl-CoA wird in den Zitratzyklus eingebracht. Die Acetylgruppe wird nämlich vom Coenzym A auf Oxalsäure übertragen. Aus der Oxalsäure mit einem Grundgerüst aus 4 C-Atomen wird dadurch eine Kette aus 6 C-Atomen, die man Zitronensäure (protoniert) oder Citrat (deprotoniert) nennt. Beide Namen kann man mit "C" oder "Z" schreiben.
| Schema des Zitronensäurezyklus |
|---|
|
|
Die auffälligsten Veränderungen an den Substraten des Zitratzyklus sind:
Der Zitratzyklus ist ein Zyklus, weil sein letztes Produkt Oxalessigsäure gleichzeitig sein erstes Substrat ist. Die oxidative Decarboxylierung der Brenztraubensäure liefert kein Zwischenprodukt des Zitratzyklus und deshalb kann auch der dafür verantwortliche Pyruvatdehydrogenase-Enzymkomplex nicht zum Citrat-Zyklus gehören. Stattdessen verbinden der Pyruvatdehydrogenase-Enzymkomplex und die von ihm katalysierte oxidative Decarboxylierung der Brenztraubensäure die Glykolyse mit dem Zitratzyklus.
Außer der hinten wieder heraus kommenden Oxalessigsäure gehen laut Buch hinein in den Citratzyklus:
1 Molekül Acetyl-CoA + 3 Moleküle H2O + 3 Moleküle NAD+ + je 1 Molekül GDP und Phosphat + 1 Molekül FAD.
Ich halte die Angabe unseres Buches für falsch, die Erzeugung von Bernsteinsäure und GTP benötige 1 Molekül H2O. Denn erstens würde bei einer nicht durch ein Enzym katalysierten Kondensation von GDP und Phosphat zu GTP ein Moleküle H2O frei. Und zweitens erfolgt laut Wikipedia die chemische Reaktion nach dem Mechanismus der "substrate-level phosphorylation" ohne Beteiligung von H2O. Meines Erachtens müsste es daher heißen:
1 Molekül Acetyl-CoA + 2 Moleküle H2O + 3 Moleküle NAD+ + je 1 Molekül GDP und Phosphat + 1 Molekül FAD.
Der Zitratzyklus liefert:
1 Molekül Coenzym A + 2 Moleküle CO2 + 3 Moleküle NADH+H+ + 1 Molekül GTP + 1 Molekül FADH2.
Der Zitratzyklus liefert mit nur einem Molekül GTP pro Umlauf wenig direkt durch die Zelle nutzbare Energie. Die zahlreicher erzeugten reduzierten Cofaktoren sind zwar energiereich, aber diese chemische Energie kann erst durch die Atmungskette zur Produktion des universellen Energieträgers der Zelle Adenosintriphosphat genutzt werden.
| Schema des Zitronensäurezyklus |
|---|
|
|
| anonymer Chemiker, Public domain |

Die folgenden Schemata sollen die chemischen Reaktionen des Zitratzyklus veranschaulichen. Dabei habe ich die räumlichen Anordnungen von den dreidimensionalen Darstellungen der offenen chemischen Datenbank PubChem der US-amerikanischen National Institutes of Health (NIH) übernommen und bei den darüber gelegten Buchstaben die relativen Atom-Durchmesser berücksichtigt. Um die Sache übersichtlicher zu machen, zeichne ich alle Strukturen in der protonierten Form, obwohl unter physiologischen Bedingungen im Mitochondrium die Carboxylgruppen deprotoniert sind.
Wenn das Acetyl-CoA aus der oxidativen Decarboxylierung in den Zitratzyklus eingebracht wird, dann hilft die energiereiche Bindung zwischen der Acetylgruppe und dem Coenzym A bei der Übertragung der Acetylgruppe auf die Oxalessigsäure.
Zunächst entfernt das Enzym Citratsynthase eines der drei Protonen aus der Methylgruppe innerhalb der Acetylgruppe. Danach ist das Kohlenstoff-Atom negativ geladen und verdrängt in der Oxalessigsäure die Doppelbindung zwischen dem zweiten C-Atom und dem Sauerstoff-Atom (Ketogruppe). Das danach nur noch einfach gebundene Sauerstoff-Atom ist negativ geladen und bindet das zuvor vom Enzym Citratsynthase aufgenommene Proton. So entsteht das noch am Enzym gebundene Zwischenprodukt Citryl-CoA. Von diesem wird das Coenzym A anschließend durch Hydrolyse abgespalten. Dabei verdrängt der Hydroxygruppe-Rest des Wasser-Moleküls das Schwefel-Atom des Coenzym A. Dabei nimmt dieses Schwefel-Atom das Elektronenpaar seiner Atombindung zum Kohlenstoff-Atom mit und bindet damit das zweite Proton des H2O. So entsteht die Zitronensäure.
Auch die zweite chemische Reaktion des Zitratzyklus erfolgt über ein Zwischenprodukt namens cis-Aconitsäure. Am Enzym Aconitase (Aconitat-Hydratase) entsteht zunächst durch eine Dehydratisierung eine Doppelbindung. Wenn anschließend die Doppelbindung des Zwischenproduktes durch Hydratisierung gelöst wird, dann bindet die Hydroxylgruppe an dem anderen C-Atom der Doppelbindung. Man nennt solche Umlagerungen Isomerisierungen und die Produkte Isomere. Daher der Name Isozitronensäure. Enzyme, die Isomerisierungen katalysieren, heißen Isomerasen.
Die dritte chemische Reaktion des Zitratzyklus ist eine oxidative Decarboxylierung und die erste von vier Redoxreaktionen im Zitratzyklus. Sie erfolgt über ein an das Enzym Isocitratdehydrogenase gebundenes Zwischenprodukt namens Oxalsuccinsäure. Während die Isozitronensäure zu α-Ketoglutarsäure und CO2 oxidiert wird, erfolgt zunächst die Reduktion von NAD+ zu NADH + H+. Anschließend wird ein Molekül CO2 abgespalten.
Auch die vierte chemische Reaktion des Zitratzyklus ist eine oxidative Decarboxylierung und die zweite von vier Redoxreaktionen im Zitratzyklus. Sie wird katalysiert am Enzymkomplex α-Ketoglutarsäure-Dehydrogenase. Während die α-Ketoglutarsäure zu Succinyl-CoA und CO2 oxidiert wird, erfolgt gleichzeitig die Reduktion von NAD+ zu NADH + H+.
Die fünfte chemische Reaktion des Zitratzyklus erfolgt am Enzymkomplex Succinyl-CoA-Synthetase und kann reversibel sein. Zunächst verdrängt anscheinend (laut Wikimedia und dem Lehrbuch: Molecular Biology of the Cell") anorganische Phosphorsäure (bzw. deren deprotoniertes Phosphat) das Coenzym A aus seiner energiereichen chemischen Verbindung mit der Bernsteinsäure. Dann scheint die Phosphatgruppe erst auf einen Histidinrest des Enzyms und schließlich auf Guanidindiphosphat übertragen zu werden. Deshalb scheint weder ein Molekül H2O für die Abspaltung des Coenzym A erforderlich zu sein, noch ein Molekül H2O bei der Verknüpfung von Phosphat und GDP zu GTP frei zu werden. Man nennt diesen Reaktionsmechanismus Substrate-level phosphorylation.
Die sechste chemische Reaktion des Zitratzyklus ist die dritte von vier Redoxreaktionen und erfolgt an dem aus vier Untereinheiten bestehenden Enzymkomplex Succinat-Dehydrogenase mit dem systematischen Namen Succinat:Ubichinon-Oxidoreduktase. Dieser ist gleichzeitig als Komplex II Teil der Atmungskette und befindet sich deshalb als einziges Enzym des Zitratzyklus in den inneren Membranen der Mitochondrien.
Von der auf Deutsch Bernsteinsäure und international in ihrer deprotonierten Form Succinat genannten Succinylsäure werden zwei Wasserstoffatome auf das fest mit dem Enzym verbundene FAD übertragen, welches dadurch zu FADH2 reduziert wird. Anschließend werden die beiden Protonen vom FADH2 abgespalten und die Elektronen durch den Enzymkomplex und die Membran hindurch auf Ubichinon (Coenzym Q) übertragen.
Das folgende animierte gif zeigt den Enzym-Substrat-Komplex und darin unten rot das FAD sowie schwarz das Substrat Succinat.
| Schema des Enzymkomplexes Succinat:Ubichinon-Oxidoreduktase |
|---|
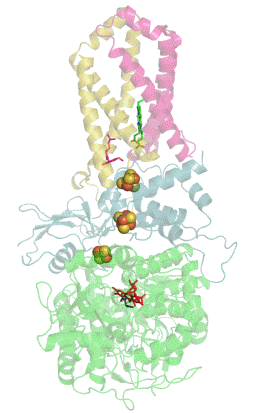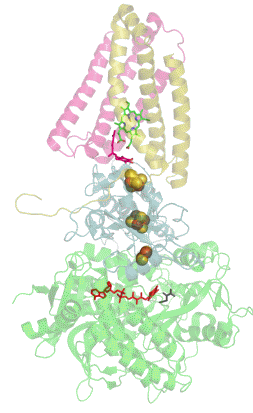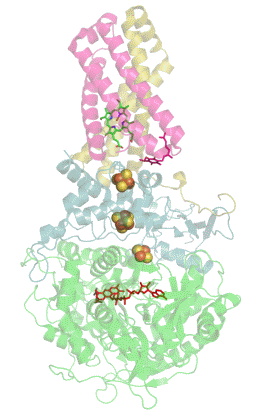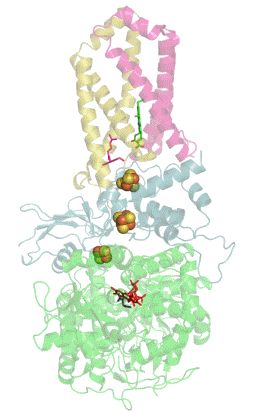
|
| anonym, Public domain |
Die siebte chemische Reaktion des Zitratzyklus ist eine Hydratisierung. Mit einem C-Atom der Doppelbindung verbindet sich eine Hydroxygruppe. Das andere C-Atom der Doppelbindung wird mit dem zweiten Wasserstoffatom abgesättigt. So entsteht aus der international in der deprotonierten Form Fumarat genannten Fumarsäure (englisch: Fumaric acid) die international in der deprotonierten Form L-Malat genannte Äpfelsäure (englisch: Malic acid).
Die achte und letzte chemische Reaktion des Zitratzyklus ist die letzte der vier Redoxreaktionen und wird katalysiert durch das Enzym Malatdehydrogenase. Es überträgt zwei Wasserstoffatome von der Äpfelsäure (englisch: Malic acid, deprotoniert: Malate) auf NAD+. Dabei wird die Äpfelsäure oxidiert zu Oxalessigsäure (englisch: Oxaloacetic acid, deprotoniert: Fumarat). Gleichzeitig wird NAD+ zu NADH+H+ reduziert.
Nachdem wir uns die 8 chemischen Reaktionen des Zitratzyklus Schritt für Schritt angesehen haben, sollten wir uns die Sache im funktionellen und räumlichen Zusammenhang ansehen. Das können wir beispielsweise mit Hilfe eines Youtube-Videos der Harvard University: Citric Acid Cycle

| Glykolyse | |
|---|---|
|
Glykolyse nennt man in der Biochemie einen zentralen Stoffwechselweg im Energiestoffwechsel und den zentralen Prozess beim Abbau aller Kohlenhydrate in allen Eukaryoten. Selbst unter Bakterien und Archaeen ist die Glykolyse weit verbreitet. In 10 hintereinander geschalteten Stoffwechselreaktionen wird das Monosaccharid Traubenzucker (Glucose) zur doppelten Anzahl von Pyruvat-Molekülen abgebaut. Dabei werden insgesamt jeweils 2 Moleküle ATP und NADH gewonnen.
Vertiefende Informationen über die Glykolyse findet man auf einer Seite der Uni Düsseldorf. |
|
| Diese Darstellung der Glykolyse habe ich auf der Grundlage eines anonym unter der Lizenz Creative Commons Attribution-Share Alike 3.0 der Wikimedia Commons zur Verfügung gestellten Schemas erstellt, um meine Schüler nicht mit anderen Namen zu verwirren und um ein im ursprünglichen Schema fehlendes Detail zu ergänzen. | |
Sieht man sich noch einmal die Glykolyse und den Zitratzyklus an, dann zählt man pro Glucose-Molekül als direkt für die Zelle nutzbare Energieträger-Ausbeute nur 2 Moleküle ATP in der Glykolyse und 2 Moleküle GTP im Zitratzyklus.
| Schema des Zitronensäurezyklus |
|---|
|
|
Die Glykolyse, die oxidative Decarboxylierung und der Zitratzyklus liefern aber relativ viele Moleküle der energiereichen Reduktionsmittel NADH und FADH2, deren Oxidation zur Energiegewinnung genutzt werden kann. Um das zu verstehen, sehen wir uns zunächst eine besondere Darstellung des Periodensystems an, die uns die relativen Atom-Durchmesser zeigt. Obwohl die chemischen Elemente der zweiten Periode von links nach rechts immer Masse-reicher werden, nehmen dabei gleichzeitig ihre Atom-Durchmesser ab. Die Elektronenschaleen werden umso kleiner, je mehr Protonen an jedem Elektron in Richtung Atomkern ziehen.
Das Element Lithium zeigt, dass schon 3 Protonen ausreichen, um das weit draußen befindliche Valenzelektron an den Atomkern zu binden. Das Element Sauerstoff hat eine viel kleinere Atomhülle und viel mehr Protonen im Atomkern. Deshalb kann Sauerstoff leicht auch Elektronen anziehen, die sich in den Atomhüllen anderer Atome befinden. Sauerstoff ist deshalb sehr elektronegativ und kann die Atome vieler anderer Elemente oxidieren. Oft setzen Oxidationen große Mengen Energie frei und genau dafür nutzen unsere Zellen der Sauerstoff, den wir einatmen.
| Periodensystem der chemischen Elemente |
|---|
|
| Bleckneuhaus, CC BY-SA 3.0 |
| Das Periodensystem ordnet die chemischen Elemente nach der Zahl ihrer Protonen, Valenzelektronen und Eigenschaften so, dass chemische Elemente mit ähnlichen Eigenschaften untereinander stehen. |

Die Atmungskette ist der letzte Abschnitt der Zellatmung oder Inneren Atmung. Sie dient der effizienten Gewinnung des universellen Energieträgers ATP aus verschiedenen energiereichen Molekülen.
Atmungskette nennen Biologen vier große Protein-Komplexe in der inneren Membran von Mitochondrien sowie die von diesen Protein-Komplexen bewerkstelligten chemischen Reaktionen, die den meisten Lebewesen zur Energiegewinnung dienen. Die Atmungskette nutzt die chemische Energie verschiedener Produkte der Glykolyse und des Zitratzyklus zur Herstellung von ATP aus ADP und Phosphorsäure. Die Mitochondrien tun das, indem sie die von Glykolyse und Zitronensäurezyklus gelieferten energiereichen Reduktionsmittel NADH und FADH2 (bzw. eigentlich Bernsteinsäure, engl. Succinat) nutzen, um Protonen durch die innere Membran aus dem Innenraum in den Zwischenraum zwischen den Membranen zu pumpen. Ermöglicht wird der Transport der Protonen durch die Energie die frei wird, während die Elektronen innerhalb der Membran durch eine Kette von Redoxreaktionen transportiert wird, bis sie schließlich dazu dienen, in der Mitochondrien-Matrix den Sauerstoff mit Protonen zu Wasser zu vereinigen. Wenn die Protonen aus dem Membranzwischenraum durch die tunnelförmige ATP-Synthase zurück in den Innenraum strömen, wird dieser Protonen-Strom zur Produktion von ATP genutzt.
| Schema der Atmungskette |
|---|
|
|
| anonym, CC BY-SA 3.0 |
Laut Stryer Biochemie 8. Auflage S. 614 verbraucht ein sitzender und 70 kg schwerer Mann hochgerechnet auf einen Tag ungefähr 83 kg ATP und muss jedes ATP-Molekül täglich etwa 300 mal aus ADP und Phosphat regenerieren, weil sein Körper nur rund 250 Gramm ATP enthält.
| Schema der Atmungskette |
|---|
|
|
| Klaus Hoffmeier, public domain |
| Schema der Atmungskette |
|---|
|
| anonym, CC BY-SA 3.0 |
Die sogenannte Atmungskette ist ein ziemlich komplexes System, das Bakterien vor Milliarden Jahren "erfunden" haben, um mit Hilfe von Sauerstoff mehr Energie aus ihrer Nahrung zu gewinnen. Nach der Endosymbiontentheorie haben wir Eukaryoten diese Erfindung von diesen Bakterien geerbt, indem die erste eukaryotische Zelle durch eine Symbiose zwischen einer Archäe und einem Bakterium entstand. Seitdem hat sich das Bakterium in den eukaryotischen Zellen durch Zellteilung vermehrt und langsam zu unseren Mitochondrien entwickelt. Um die Atmungskette zu verstehen oder wenigstens einen Eindruck von ihrer Komplexität zu gewinnen, sollte man die modernste Technik zur Vermittlung biologischen Wissens nutzen und sich die Lehrvideos führender Universitäten ansehen. Darin erklären professionelle Sprecher die Vorgänge vor dem Hintergrund von Animationen, die den Stand der Forschung visualisieren. Zu den in dieser Hinsicht weltweit führenden Institutionen gehört die Harvard University, die ihre Lehrvideos kostenlos bei Youtube zur Verfügung stellt:
Wer meint, dass man entsprechendes doch auch auf Deutsch finden müsste, der wird selbstverständlich auf Youtube auch mit dem Suchwort Atmungskette fündig.
In Mitochondrien wird die freie Enthalpie (Gibbs Energie) der in Glykolyse und Zitratzyklus produzierten FADH2- und NADH-Moleküle genutzt, um im Rahmen der Atmungskette einen Ionen-Gradient aufzubauen, dessen freie Enthalpie dann in die freie Enthalpie des universellen Energieträgers ATP überführt wird.