EG-Seminar "Tierschutz", 24. August - 2. Sept. 1999, Dublin
Tierschutzgerechte Betäubung von Schlachtgeflügel - Teil I: Elektrobetäubung
Dr. Ingrid Schütt-Abraham, 24.10.2007

|
EG-Seminar "Tierschutz", 24. August - 2. Sept. 1999, Dublin Tierschutzgerechte Betäubung von Schlachtgeflügel - Teil I: Elektrobetäubung Dr. Ingrid Schütt-Abraham, 24.10.2007 |
 |
Navigate with the following links:

Gliederung |
||
|---|---|---|

|
1. | Einleitung |
 |
2. | Wasserbadbetäubung |
 |
3. | Anforderungen an eine wirksame Betäubung |
 |
4. | Kriterien zur Beurteilung der Betäubungstiefe: 4.1 Epileptischer Anfall / 4.2 Evozierte Potentiale (EP) |
 |
5. | Definition einer wirksamen Elektrobetäubung von Schlachtgeflügel |
 |
6. | Stromstärken für eine wirksame Betäubung |
 |
7. | Einwirkungszeiten für eine wirksame Betäubung |
 |
8. | Eintauchtiefe |
 |
9. | Beurteilung der Betäubungswirkung unter Praxisbedingungen: 9.1 Muskeltonus / 9.2 Atmung / 9.3 Reflexe / 9.3.1 Cornealreflex / 9.3.2 Kammreflex |
 |
10. | Klinische Zeichen einer Betäubung mit Herzkammerflimmern bei Schlachtgeflügel |
 |
11. | Technische Vorgaben bei der Wasserbadbetäubung: 11.1 Ganzkörperdurchströmung / 11.2 Gruppenbetäubung / 11.3 Einstellen des Betäubers auf die geforderten Stromstärken / 11.4 Minimierung des Widerstandes / 11.4.1 Kontakt zwischen Ständer und Schlachtbügel / 11.4.2 Widerstand des Wassers |
 |
12. | Tierschutzprobleme bei der Wasserbadbetäubung: 12.1 Einhängen / 12.2 Vorzeitige Stromstöße / 12.2.1 Vorzeitige Stromstöße durch überfließendes Wasser / 12.2.2 Vorzeitige Stromstöße infolge der Körperhaltung der Tiere / 12.3 Unvollständiges oder verzögertes Eintauchen der Köpfe |
 |
13. | Anforderungen an das Entbluten |
 |
14. | Elektrische Kopfdurchströmung mit Zange |
 |
15. | Elektrische Betäubung und Schlachtkörperqualität: 15.1 Ausblutung / 15.2 Knochenbrüche und Blutungen / 15.2.1 Knochenbrüche im Schultergürtel / 15.2.2 Brustmuskelblutungen / 15.3 Andere Schlachtschäden / 15.4 Fleischqualität |
 |
16. | Verantwortung der zuständigen Behörde bei der Wasserbadbetäubung |
 |
17. | Literatur |

Die grundsätzlichen Tierschutzvorgaben für die Betäubung von Geflügel vor der Schlachtung sind in der Richtlinie 93/119/EG niedergelegt (im Folgenden nur "die Richtlinie" genannt). Verfahren zur Betäubung sollen die Tiere sofort bewusstlos machen, bis der Tod durch Entbluten eintritt, und dürfen selbst keine vermeidbare Aufregung oder Schmerzen verursachen.
In kommerziellen Geflügelschlachtbetrieben, in denen Tausende von Tieren pro Stunde geschlachtet werden, wurde eine Automatisierung des Schlachtprozesses schon sehr früh notwendig. Die Elektrobetäubung im Wasserbadbetäuber entwickelte sich daher zur Methode der Wahl: sie sicherte die notwendige Immobilisierung der Tiere vor dem automatischen Entbluteschnitt, passte selbst nahtlos in den Automatisierungsprozess und war kostengünstig. Bis heute ist der Wasserbadbetäuber das gebräuchlichste Verfahren zur Geflügelbetäubung in gewerblichen Schlachtbetrieben.

Bei diesem elektrischen Betäubungsverfahren müssen die Vögel aus ihren Transportkäfigen entnommen und kopfüber mit den Beinen in metallene Schlachtbügel einer Förderkette gehängt werden. Ihre Köpfe werden dann durch ein Wasserbad gezogen, das an eine Stromquelle angeschlossen ist. Der elektrische Stromkreis wird geschlossen, sobald der Kopf der Tiere ins Wasser taucht und die Schlachtbügel Kontakt mit einer metallenen Ableitstange bekommen, die am Betäuber angebracht ist.
Dieses Verfahren unterscheidet sich in drei Punkten wesentlich von der Elektrobetäubung anderer Schlachttiere:

Gemäß der Richtlinie muss die Betäubung einen sofortigen Verlust des Bewusstseins bewirken, der bis zum Tode der Tiere anhält. Bewusstlosigkeit kann als ein Zustand der Wahrnehmungs- und Empfindungslosigkeit definiert werden, d.h., das Tier fühlt weder Schmerz noch empfindet es Stress, Aufregung oder Angst.
Elektrische Ströme, die nicht zu sofortiger Betäubung führen, können als schmerzhaft empfunden werden, auch wenn das Gehirn in den Stromweg eingeschlossen ist. Schweine, die durch einen Stromstoß von 1 Sekunde Dauer durch den Kopf nicht betäubt wurden, schrieen und unternahmen heftige Fluchtversuche (Simmons, 1995). Hühner verließen den Wasserbadbetäuber schreiend und flügelschlagend in einem vergeblichen Versuch, davonzuflattern (Ali et al., 1995; Wormuth et al., 1981). Dieses offenkundig schmerzhafte Erlebnis einer unzureichenden Stromeinwirkung kann nur bei relativ kurzen Einwirkungszeiten demonstriert werden, da eine verlängerte Ganzkörperdurchströmung stets auch eine immobilisierende Nebenwirkung hat. Zudem kann eine verlängerte Durchströmungszeit mit einem späteren Einsetzen einer wirksamen Betäubung einhergehen, die von retrograder Amnesie begleitet ist. Nichtsdestotrotz kann selbst ein verspäteter Betäubungseintritt nur die Erinnerung an die ersten schmerzvollen Sekunden auslöschen, nicht aber deren Erleiden. Angesichts dieser Erkenntnis ist zu fordern, dass der Eintritt der Betäubung bei elektrischer Durchströmung sofort erfolgt.

Frühe Untersuchungen der elektrischen Betäubung von Kaninchen beschreiben eine Phase nach dem Elektroschock, in der die Tiere eine Herzreaktion auf Schmerzreize zeigten, obwohl sie dem Anschein nach bewußtlos waren (Croft, 1952). Dies zeigt, dass die Tiefe und Dauer der Betäubung nicht zuverlässig allein aus dem Verhalten der Tiere abgeleitet werden kann. Um dieses Problem zu überwinden wurden Laborversuche durchgeführt, bei denen das Elektroenzephalogramm (EEG) registriert wurde. Das EEG dient zum Nachweis von Veränderungen der Funktionsfähigkeit des Zentralnervensystems, die mit der Annahme eines vorhandenen Bewusstseins unvereinbar sind.
Zur Auswertung des EEG wurden vorwiegend zwei Kriterien herangezogen: das Auftreten eines epileptischen Anfalls, und der Verlust evozierter Potentiale.

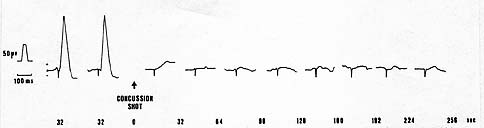
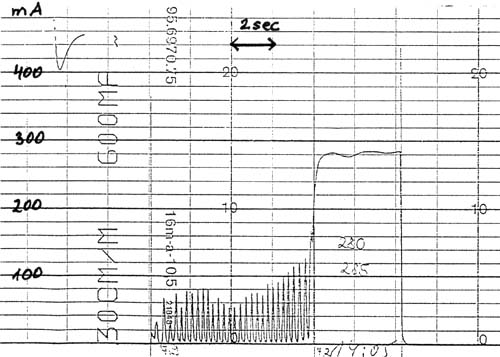
Wenn man einen elektrischen Strom von genügender Stärke durch das Gehirn eines Schlachttieres leitet, wird ein epileptischer Anfall ausgelöst. Im Spontan-EEG von Hühnern kann dies durch eine Serie hochamplitudiger niederfrequenter Spitzen demonstriert werden, die häufig, jedoch nicht immer, von elektrischer Stille gefolgt sind (Darst. 1). Während eines generalisierten epileptischen Anfalls ist beim Menschen das Bewusstsein verloren, wie man aus Untersuchungen der Humanmedizin weiß. Diese Methode wurde von der Arbeitsgruppe in meinem Institut verwendet.
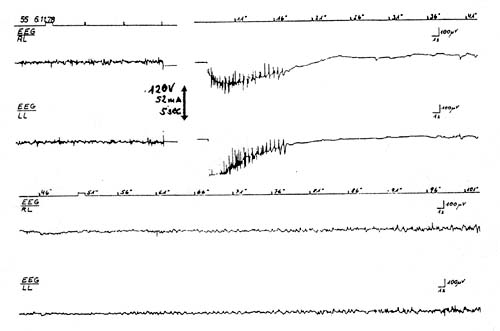

Ein etwas neuerer Ansatz zur Feststellung, in welchem Umfang ein Betäubungsverfahren die Gehirnfunktion beeinflusst, ist die Untersuchung evozierter Potentiale. Diese Methode wurde von der Arbeitsgruppe der Universität Bristol/Großbritannien eingesetzt. Sie zeigt, ob das Gehirn noch auf einem Niveau funktioniert, auf dem es Reize aus der Umwelt empfangen und verarbeiten kann. Solche Reize können z.B. Lichtblitze sein (Untersuchung visueller evozierter Potentiale, abgekürzt VEP) oder eine elektrische Reizung der Körperperipherie (Untersuchung somatosensorischer evozierter Potentiale, abgekürzt SEP). Solche Reizantworten sind unmittelbar nach einer sofort wirksamen Betäubung ausgelöscht (Gregory et al., 1990c) wie bei einer durch Gehirnerschütterung verursachten Bewußtlosigkeit (Darst. 2).
Bei Hühnern besteht eine ausreichend enge Beziehung zwischen dem Auftreten eines epileptischen Anfalls im EEG und der Nichtauslösbarkeit evozierter Potentiale infolge einer Betäubung (Gregory und Wotton, 1989), obwohl bei einem kleinen Anteil der Tiere evozierte Potentiale auch während eines epileptischen Anfalls auslösbar sein können. Allerdings bedeutet das Vorhandensein solcher VEP oder SEP nicht zwangsläufig, dass das Tier bei Bewusstsein ist, da sie auch in anaesthesierten Tieren ausgelöst werden können. Ihr Verlust beweist demgegenüber das Vorliegen einer schweren funktionellen Störung des Zentralnervensystems, die mit der Annahme vorhandenen Bewusstseins unvereinbar ist (Gregory und Wotton, 1990).

Obwohl ein epileptischer Anfall bei einzelnen Hühnern schon mit Stromstärken von weniger als 30 mA ausgelöst werden kann (Gregory und Wotton, 1987, Schütt-Abraham et al., 1983, Wormuth et al., 1981), kann er regelmäßig erst ab Stromstärken oberhalb 65 mA beobachtet werden (Schütt-Abraham et al., 1983; Wormuth et al., 1981). Ein gleichzeitiger Verlust evozierter Potentiale kann zuverlässig nur bei Stromstärken von 120 mA und mehr erwartet werden (Gregory und Wotton, 1990).
Darüber hinaus dauern bei Hühnern die Polyspike-Komplexe eines epileptischen Anfalls nur 11 bis 24 sec (Wormuth et al., 1981) und sind im Durchschnitt bei im Wasserbad betäubten Tieren 17 sec nach Beginn des Stromflusses beendet (Gregory und Wotton, 1987). Eine nachfolgende elektrische Stille ist, sofern überhaupt vorhanden, üblicherweise innerhalb 20 bis 30 sec nach Beginn des Stromflusses beendet (Schütt-Abraham et al., 1983, Wormuth et al., 1981). Die durchschnittliche Zeit bis zum kompletten Erlöschen der spontanen Gehirnaktivität beträgt beim Huhn nach Durchtrennung beider Carotiden 60 sec (Gregory und Wotton, 1986).
Bei reversibler Elektrobetäubung im Wasserbad ist der epileptische Anfall daher wahrscheinlich beendet bevor Bewußtlosigkeit aufgrund des Ausblutens garantiert werden kann. Wenn die Betäubung jedoch gleichzeitig Herzkammerflimmern und in dessen Folge Herzstillstand bewirkt, ist der Ausfall der Hirnfunktionen irreversibel (Schütt-Abraham et al., 1983, Wormuth et al., 1981).
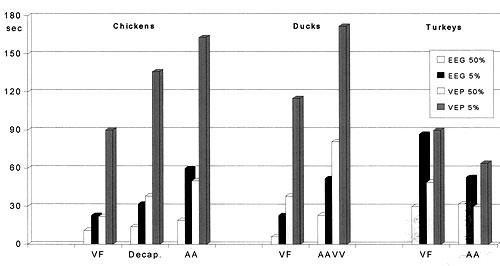
Herzkammerflimmern ist die schnellste Methode, mit der evozierte Potentiale in Hühnern und Enten ausgelöscht werden können, und eine rasche in Puten (Gregory und Wotton, 1986; Gregory und Wotton, 1988). Es beendet die spontane Hirnaktivität in Hühnern und Enten innerhalb 20 - 30 sec (Gregory und Wotton, 1986; Schütt-Abraham et al., 1983, Wormuth et al., 1981) (Darst. 3).
Um einen sofortigen und irreversiblen Verlust des Bewusstseins zu erzielen haben daher beide Arbeitsgruppen zur Betäubung von Schlachtgeflügel Stromstärken empfohlen, die nicht nur zu einem epileptischen Anfall führen, sondern auch Herzkammerflimmern auslösen. Diese Empfehlung findet sich auch im Report des Wissenschaftlichen Veterinärausschusses (SVC) von 1997. Nur das gleichzeitige Auslösen von Herzkammerflimmern sichert einen nahtlosen Übergang der durch den Stromstoß verursachten reversiblen Bewusstlosigkeit in irreversibles Koma und den Tod.
Es gab Leute, die besorgt waren, dass das Entbluten eines Huhnes mit Herzkammerflimmern einem Töten im Verenden gleichkommt. Die Verwendung solcher Tiere zum menschlichen Genuss ist nach fleischhygienerechtlichen Regelungen verboten. Inkonsequenter Weise wurde diese Argumentation jedoch nicht auch auf die Bolzenschussbetäubung angewendet, bei der die Entblutung des Tieres gleichfalls in Agonie erfolgt. Hinter der Gesetzgebung steht, dass Tiere aus der Lebensmittelkette ferngehalten werden sollen, die aufgrund einer nicht erkannten Krankheit oder auch Vergiftung verendet, d.h. ohne äussere Einwirkung gestorben sind, da ihr Fleisch eine Gesundheitsgefahr für den Menschen darstellen könnte. Bei der Elektrotötung wie der Bolzenschussbetäubung ist die Agonie jedoch das Ergebnis einer mit dem Ziel der Tötung des Tieres vorgenommenen Schlachthandlung; daher widerspricht der Einsatz dieser Verfahren nicht den fleischhygienerechtlichen Prinzipien. Artikel 5 der Richtlinie 93/119/EC erlaubt ausdrücklich den Gebrauch von Tötungsverfahren zur Betäubung vor der Schlachtung. Auch empfiehlt der SVC ausdrücklich Methoden, die nicht nur betäuben, sondern auch töten. Die Richtlinie lässt darüber hinaus den Gebrauch des Wasserbadbetäubers für Geflügel ausdrücklich zu. Da bei der Wasserbadbetäubung der Strom zwangsläufig über das Herz fließt, kann bei den traditionellen sinus 50 Hz - Strömen die Gefahr des Herzkammerflimmerns nie ausgeschlossen werden. Selbst wenn nur so geringe Stromstärken wie 30 bis 45 mA durch ein Huhn fließen, kann dies bei 5 bis 10 % der Tiere zu Herzkammerflimmern führen (Gregory und Wotton, 1987; Wormuth et al., 1981). Herzstillstand kann den Ausblutungsprozess in Geflügel zwar verlangsamen, führt jedoch nicht zu einer Beeinträchtigung des Ausblutungsgrades, wie später gezeigt wird.

Die Stromstärkeschwellenwerte für einen epileptischen Anfall sind allgemein niedriger als die für das Auslösen von Herzkammerflimmern. Demzufolge wäre letztere der limitierende Faktor. Folgende Mindeststromstärken (Effektivwerte) je Tier wurden empfohlen (BGA, 1990; Gregory und Wotton, 1990; Gregory und Wotton, 1991; Gregory und Wotton, 1991b; Knauer-Kraetzl, 1991; Schütt-Abraham und Wormuth, 1991; Wormuth et al., 1981) und sind in Deutschland nach der Tierschutz-Schlachtverordnung vorgeschrieben:
| Empfohlene Stromstärken für | ||||
|---|---|---|---|---|
| Hühner | 120 mA | |||
| Enten, Gänse | 130 mA | |||
| Puten | 150 mA | |||
In Wachteln führt eine Ganzkörperdurchströmung mit Stromstärken von 50 mA oder mehr regelmäßig zu Herzkammerflimmern (Gregory et al., 1991). Perlhühner wurden regelmäßig mit Stromstärken über 80 mA getötet (Schütt-Abraham et al., 1987; Schütt-Abraham und Wormuth, 1988).
Die empfohlenen Stromstärken beruhen vorwiegend auf Untersuchungen, bei denen Wechselströme von sinus 50 Hz verwendet wurden - die europäische Netzspannung. Sie führen bei mindestens 90 % der Hühner zu Herzkammerflimmern (BGA, 1990; Fricker und Müller, 1981; Gregory und Wotton, 1987; Gregory und Wilkins, 1989c; Gregory und Wotton, 1990; Gregory und Wilkins, 1990; Gregory et al., 1991; Knauer-Kraetzl, 1991; Schütt-Abraham et al., 1987) und korrespondieren gut mit den Stromstärken, die für einen sofortigen und anhaltenden Verlust evozierter Potentiale bei Huhn Gregory und Wotton, 1990) und Pute (Gregory und Wotton, 1991b) erforderlich sind.
Aus verschiedenen Gründen, z.B. zum Ausschluss von Herzkammerflimmern beim rituellen Schlachten oder zur Verbesserung der Schlachtkörperqualität, werden heute häufig Stromfrequenzen eingesetzt, die wesentlich von sinus 50 Hz abweichen. Bei Frequenzen oberhalb 100 Hz sinkt jedoch zunehmend die Rate von Herzkammerflimmern. 350 Hz reduzierte das Auftreten von Herzkammerflimmern auf weniger als 10 %, und bei 1500 Hz wurde überhaupt kein dadurch verursachter Herzstillstand mehr beobachtet (Gregory et al., 1991), so dass aus Gründen des Tierschutzes sofortiges Entbluten unter Durchtrennung beider Carotiden zwingend geboten ist. Darüber hinaus nimmt der Anteil von Tieren mit Herzkammerflimmern bei Puten, die mit einer konstanten Stromstärke von 150 mA betäubt wurden, bei steigender Stromfrequenz deutlich ab. Alle untersuchten Hennen bekamen bei 50 Hz Kammerflimmern, nur noch 60% bei 300 Hz, bei 480 oder 550 Hz waren es nur noch 30%, während 600 Hz von allen Tieren überlebt wurde. Die korrespondierenden Werte für Putenhähne waren 53 % bei 50 Hz und 38 % bei 300 Hz, während Kammerflimmern bei höheren Frequenzen nicht mehr auftrat (Mouchoniere et al., 1999). Diese Anteile belegen allerdings lediglich den Trend, da die Zahl der Tiere je Gruppe gering war (nur zwischen 10 bis 17 Tiere).
In Schweinen, die mit 1.6 bis 2.3 A betäubt wurden (diese Stromstärke ist deutlich höher als die bei dieser Tierart empfohlenen und in Deutschland vorgeschriebenen 1.3 A) unterschied sich qualitativ und von der Dauer her der epileptische Anfall nach dem EEG bei mit 50 Hz betäubten Tieren nicht von dem, der mit Frequenzen bis zu 7000 Hz ausgelöst worden war. Während Krampfanfälle bei Hochfrequenzbetäubung heftiger waren und rascher einsetzten, gelegentlich schon, während die Tiere noch unter Stromeinwirkung standen, wurde die Wiederkehr von Cornealreflex und Atumung nicht beeinflusst (Simmons, 1995). Jedoch wurde bei hochfrequenten Strömen nahe oder unterhalb der vorgesehenen 1.3 A eine frühere Rückkehr von Cornealreflex und regelmäßigen Atembewegungen in Schweinen beobachtet, was ein Entbluten innerhalb 6 Sekunden erforderte (Anil und McKinstry, 1992). Dies legt die Schlussfolgerung nahe, dass mit hochfrequenten Strömen eine höhere Stromstärke nötig sein könnte, um das Auftreten eines epileptischen Anfalls sicherzustellen. Tatsächlich wurde berichtet, dass die Schwelle für das Auslösen eines epileptischen Anfalls mit zunehmender Stromfrequenz anstieg. Die Betäubung von Schweinen mit 2000 Hz erforderte grob 50 % mehr Strom als die Betäubung mit 50 Hz (Simmons, 1995).
Relativ wenige der bis 1999 veröffentlichten Untersuchungen befassten sich mit den Tierschutzaspekten der Hochfrequenzbetäubung bei Geflügel. Ein gepulster Gleichstrom von 350 Hz und 120 mA (Effektivstromstärke) brachte evozierte Potentiale in Hühnern zum Erlöschen (Gregory und Wotton, 1991). Dies belegt eine wirksame Betäubung obwohl die Rate von Herzkammerflimmern auf unter 10 % sank (Gregory et al., 1991; Gregory und Wotton, 1991). Bei 1500 Hz fiel die Herzkammerflimmernrate auf Null (Gregory et al., 1991), aber die Mindeststromstärke, die zum Ausfall der evozierten Potentiale bei dieser Frequenz erforderlich war, wurde leider nicht angegeben. Die Ergebnisse von Untersuchungen in Puten lassen vermuten, dass ein Anstieg der Frequenz eines stromstärkekonstanten Stromes die Zeit bis zum Wiedererwachen - gemessen an klinischen Zeichen - verkürzt (Mouchoniere et al., 1999).
Um den Tierschutz trotz des Fehlens experimenteller Belege zu gewährleisten, sollte davon ausgegangen werden, dass auch bei Geflügel höhere Stromstärken als bei sinus 50 Hz gefordert nötig sein könnten, um eine gleich wirksame Betäubung hervorzurufen.
Richtlinie 93/119/EC fordert von den zuständigen Behörden, dass diese die angemessenen Stromstärken und Einwirkungszeiten vorgeben (Anhang C II. 3. B. Nr. 1 und 2). Die oben angeführten Empfehlungen, die vom Europarat angenommen wurden, sind in die deutsche Tierschutz-Schlachtverordnung vom März 1997 eingegangen. Der 1997 erstellte Bericht des SVC unterstützt die Aufnahme der empfohlenen Mindeststromstärken für Enten, Gänse und Puten in die Richtlinie und empfiehlt 120 mA für Hühner (wobei 100 mA als Minimum für diese Tierart angesehen werden).

Der elektrische Strom muss für eine tierschutzgerechte Betäubung innerhalb der ersten Sekunde des Stromflusses den Schwellenwert erreichen, der zum Auslösen des epileptischen Anfalls führt. Obwohl demgegenüber das Auslösen von Herzkammerflimmern am betäubten Tier nicht unbedingt sofort erfolgen muss, ist auch hier die Stärke des elektrischen Stromes weitaus wichtiger als seine Dauer. Innerhalb der üblichen Bandbreite der Stromflussdauer im Wasserbadbetäuber von 2 - 12 Sekunden können Stromstärken, die unzureichend für das Auslösen von Herzkammerflimmern sind, nicht durch eine Verlängerung der Einwirkungszeit kompensiert werden (BGA, 1990; Knauer-Kraetzl, 1991). Solange die Betäubung schlagartig einsetzt, spielen jedoch ein paar Sekunden bis zum Erreichen der Schwelle für das Auslösen von Herzkammerflimmern eine untergeordnete Rolle. Stromstärken erreichen ihr ungefähres Maximum bei Wasserbadbetäubung von Puten und Broilern innerhalb 2 sec und in Legehennen innerhalb 4 sec (BGA, 1990; Knauer-Kraetzl, 1991; Schütt-Abraham et al., 1987; Wormuth et al., 1981), während es bei Wassergeflügel einige Sekunden mehr braucht (BGA, 1990; Knauer-Kraetzl, 1991). Der Strom sollte daher nicht unter 4 sec durch Hühner und Puten bzw. 6 sec durch Enten und Gänse fließen.
Eine Verlängerung der Stromflusszeit kann die immobilisierende Wirkung des Stromes verstärken. In diesem Fall muss man allerdings sicherstellen, dass hierdurch nicht eine unzureichende Betäubungswirkung verdeckt oder das Aussehen des Schlachtkörpers bzw. die Fleischqualität negativ beeinflusst wird.
Darüber hinaus muss man zwischen der Stromflussdauer und der Passagezeit für den Wasserbadbetäuber unterscheiden. Diese dürfen nicht synonym gebraucht werden! Unter Praxisbedingungen kann die Zeit, während der die Tiere dem Strom ausgesetzt sind, deutlich kürzer sein als die Zeit, die für die Passage des Wasserbadbetäubers benötigt wird.

Nur vollständiges Eintauchen der Köpfe der Tiere gewährleistet einen ausreichenden Stromfluss durch das Gehirn. Hierzu werden in Anhang C II B Nr.1 der Richtlinie 93/119/EC Vorgaben gemacht. Wir empfehlen, die Tiere bis zum Flügelansatz eintauchen zu lassen, um einen guten Kontakt mit dem Wasser auch bei gelegentlich vorkommenden Kümmerern sicherzustellen.
Tiefes Eintauchen erleichtert zudem das Erreichen der Schwellenstromstärke für das Auslösen von Herzkammerflimmern. Gänse, die bei 250 V betäubt werden, erhalten etwa 20 mA mehr, wenn sie bis zum Flügelansatz eintauchen, als wenn sie nur bis zu den Augen eintauchen(Schütt-Abraham et al., 1992). Befürchtungen, dass eine solche Eintauchtiefe die Betäubungswirkung beeinträchtigt, ließen sich nicht bestätigen (Gregory und Wotton, 1991c).

Während der Routineschlachtung in einem gewerblichen Schlachtbetrieb ist es unmöglich, das EEG oder das EKG aufzuzeichnen. Daher muss man

Der Beginn des Stromflusses führt aufgrund der direkten elektrischen Stimulation zu einer schlagartigen Kontraktion der Skelettmuskulatur. Die Tiere werden starr, ihre Flügel sind an den Körper gezogen und der Hals ist infolge der Verkrampfung der Muskulatur beim Huhn auf den Rücken gebogen. Sofern der Strom zu einem epileptischen Anfall geführt hat, wird das Tier auch nach dem Ende des Stromflusses noch einige Zeit im tonischen Krampf verharren. Vögel, welche diese Starre in dem Augenblick verlieren, wo der Strom unterbrochen wird, haben wahrscheinlich keinen epileptischen Anfall erlitten. Übersteigt jedoch die Dauer des Stromflusses die Phase des tonischen Krampfes, können die Tiere den Betäuber auch bereits erschlafft verlassen. Solange die Betäubung sofort einsetzt und die Tiere neben dem epileptischen Anfall Herzkammerflimmern entwickeln, ist eine verlängerte Stromflussdauer für den Tierschutz nicht von Belang.
Die Unterdrückung oder sogar das Ausbleiben der klonischen Phase (Zuckungen oder Flügelschlagen der Tiere nach dem tonischen Krampf) kann auf den Stromfluss durch das Rückenmark zurückgeführt werden, da bei lediglich mit Kopfdurchströmung betäubten Hühnern die klonische Phase stark ausgeprägt ist (Gregory und Wotton, 1990; Gregory und Wotton, 1990b; Wormuth et al., 1981).
Bei Stromstärken unterhalb des für die Immobilisierung benötigten Wertes verließen Hühner den Betäuber schreiend und flügelschlagend. Dies war bei Stromstärken von weniger als 20 - 25 mA je Tier zu beobachten (Schütt-Abraham et al., 1983, Wormuth et al., 1981).
Hühner, die Herzkammerflimmern entwickeln, erlangen ihren Muskeltonus nach dem Ende des epileptischen Anfalls nicht wieder und können daher 30 bis 40 Sekunden nach Durchströmungsbeginn an ihrem "gesträubten" Nackengefieder erkannt werden. Hühner mit erhaltener Herztätigkeit legen demgegenüber ihr Nackengefieder innerhalb dieser Zeit wieder an (Schütt, 1982; Wormuth et al., 1981). Sie sind durchschnittlich innerhalb 1 Minute in der Lage, ihren Kopf der ihn erfassenden Hand zu entziehen. Einige Tiere erlangten diese Fähigkeit sogar bereits innerhalb 5 - 25 Sekunden nach dem Beginn des Stromflusses wieder, wenn die Stromstärken deutlich unterhalb der empfohlenen lagen (Gregory und Wotton, 1990). Ein anderes Mittel, um zwischen Hühnern mit und ohne Herzkammerflimmern unterscheiden zu können, sind hypoxämische Krämpfe, die häufig im Laufe der Ausblutung bei Tieren mit erhaltener Herztätigkeit auftreten (Gregory und Wilkins, 1989c; Griffiths et al., 1985; Richards und Sykes, 1964 Schütt, 1982).

Während des Stromflusses und unter dem Einfluss des epileptischen Anfalls ist die Atmung unterbunden. Hühner, welche die Betäubung überlebt haben, atmen innerhalb 30 - 40 Sekunden wieder regelmäßig (Gregory und Wotton, 1990; Schütt-Abraham et al., 1987). Bei Hühnern, Perlhühnern, Enten und Wachteln mit Herzkammerflimmern ist der Ausfall der Atmung irreversibel(Schütt-Abraham et al., 1987). In Puten (und Gänsen) können respiratorische Bewegungen vorübergehend wiederkehren, selbst, wenn die Tiere Herzkammerflimmern erleiden und sich von der Betäubung nicht wieder erholen (Schütt-Abraham et al., 1987). Dies stimmt mit der Beobachtung überein, dass es bei Puten deutlich länger dauert als bei Hühnern, bis der Tod infolge Sauerstoffmangels eintritt (Raj, 1994).
Das Wiedereinsetzen der regelmäßigen Atmung ist auch bei Geflügel das wichtigste klinische Zeichen für eine Wiederkehr der Gehirnfunktionen und von der agonalen oder Schnappatmung zu unterscheiden.

Reflexe, an denen der Hirnstamm beteiligt ist, sind kein zwingendes Anzeichen von Bewusstsein, da sie auch beim anaesthesierten Tier ausgelöst werden können. Ihre Rückkehr nach elektrischer Betäubung demonstriert jedoch die beginnende Erholung der Funktionsfähigkeit des Zentralnervensystems, welches Voraussetzung für die Rückkehr des Bewusstseins ist.

Der Cornealreflex ist normalerweise für eine kurze Zeit nach dem Stromfluss erloschen. In Vögeln, die den Betäuber gerade verlassen haben, ist die Nickhaut häufig vor die Augen gezogen und der Reflex kann nicht geprüft werden. Seine regelmäßige Auslösbarkeit unmittelbar nach Beendigung des Stromflusses würde jedoch auf eine unzureichende Betäubungswirkung hindeuten.
Die Rückkehr des Cornealreflexes nach Elektrobetäubung signalisiert wie das Wiedereinsetzen der regulären Atmung die beginnende Erholung der Hirnfunktionen. In Puten und Gänsen mit Kammerflimmern kann eine vorübergehende Rückkehr des Cornealreflexes beobachtet werden, bevor er für immer erlischt (Schütt-Abraham et al., 1987). In Broilern, Legehennen, Perlhühnern und Enten mit Herzkammerflimmern ist er hingegen irreversibel erloschen. Ein negativer Befund 30 - 40 Sekunden nach dem Beginn des Stromflusses kann daher zur Feststellung einer tierschutzgerechten Betäubung mit Herzkammerflimmern herangezogen werden. In Überlebenden kann er zu dieser Zeit regelmäßig ausgelöst werden(Schütt, 1982; Schütt-Abraham et al., 1987), in einigen Tieren bis zu 3 1/2 min nach dem Entbluteschnitt (Wormuth et al., 1981). In dekapitierten Hühnern überdauert er durchschnittlich 23 sec (Wormuth et al., 1981). In Schlachtbetrieben wurde ein relativ guter Zusammenhang zwischen dem Anteil von Hühnern mit erloschenem Cornealreflex 30 Sekunden nach dem Entbluteschnitt und dem Anteil von Tieren mit mittels EKG nachgewiesenem Herzkammerflimmern gefunden (Weise et al., 1988).

Der Kammreflex ist üblicherweise unmittelbar nach der Elektrobetäubung erloschen und kann bis zu mehr als 3 Minuten nicht auslösbar sein, obwohl die Tiere zu diesem Zeitpunkt das Bewusstsein offenkundig wiedererlangt haben (Wormuth et al., 1981). Ob dies auf eine echte analgetische Wirkung deutet wie sie bei elektrisch betäubten Schafen nachgewiesen wurde (Gregory und Wotton, 1988b) oder auf einen durch den Stromfluss hervorgerufenen Zustand der Immobilisierung zurück geht (Croft, 1952) bleibt festzustellen. Auf der anderen Seite würde ein positiver Kammreflex unmittelbar nach der Betäubung klar auf eine unzureichende Betäubung weisen und war mit augenfällig bewußtem Verhalten der Tiere vergesellschaftet (Richards und Sykes, 1964).

In Hühnern und Perlhühnern können die klinischen Anzeichen einer wirksamen und damit tierschutzgerechten Betäubung mit Herzkammerflimmern wie folgt zusammengefasst werden (Darst. 4):
Darst. 4: Anzeichen einer Betäubung mit Herzkammerflimmern bei Hühnern
| vollständige Erschlaffung des Vogels ('gesträubtes' Halsgefieder innerhalb 30 - 40 Sekunden nach Beginn des Stromflusses |
| irreversibler Ausfall des Cornealreflexes |
| irreversibler Ausfall der Atmung |
| keine Konvulsionen ('Flügelschlagen') während der Entblutung |
Diese Symptome sind weniger deutlich in Enten. In Puten und Gänsen eignen sie sich nicht zur Unterscheidung von Tieren mit und ohne Kammerflimmern am Band, da der Cornealreflex, Atembewegungen und Muskeltonus zwar oft nach einem Stromstoß erloschen sind, jedoch zeitweilig auch bei Tieren mit Herzkammerflimmern zurückkehren können (Schütt-Abraham et al., 1987). Wenn man Zweifel daran hat, dass die Tötung erfolgreich war, muss man die Tiere aus der Förderkette aushängen und zur weiteren Beobachtung ablegen, um nach Anzeichen einer Erholung wie dauerhafter regulärer Atmung oder Aufrichtversuchen Ausschau zu halten.
Um die Wirksamkeit der Betäubung anhand der klinischen Symptome unter Praxisbedingungen einschätzen zu können, sollte man eher auf das Verhalten der Gruppe als einzelner Tiere achten. Selbst bei Puten, bei denen die Beurteilung der Betäubungstiefe bei Individuen mit Hilfe des Cornealreflexes und der Atmung nicht so zuverlässig ist wie bei Hühnern oder Enten, kann man eine Verbesserung der Betäubungsbedingungen, die zu einer tieferen Betäubung führen, anhand eines reduzierten Anteils von Tieren erkennen, die auf Berührung der Cornea reagieren oder zwischen dem Verlassen des Betäubers und dem Entbluten wieder anfangen zu atmen.
Praktische Überprüfungen in Geflügelschlachtbetrieben zur Beurteilung der Übereinstimmung der dort angewendeten Betäubungs- und Entblutungsmethoden mit den Anforderungen der Richtlinie beschränken sich in der Regel auf das spontane Verhalten und die Reaktionen der Vögel an verschiedenen Punkten entlang der Schlachtlinie. Da die Wasserbadbetäubung von Geflügel zu einem sofortigen Verlust des Bewusstseins führen soll, der bis zum Tod durch Entbluten anhält, und da die Vögel beim Eintritt in den Brühtunnel zumindest im tiefen Koma liegen sollen, sollten als Inspektionspunkte der Eintritt ins Wasserbad, der Austritt aus dem Wasserbad, der Entblutungsplatz, die Entblutestrecke und der Eintritt in den Brühtunnel gewählt werden.


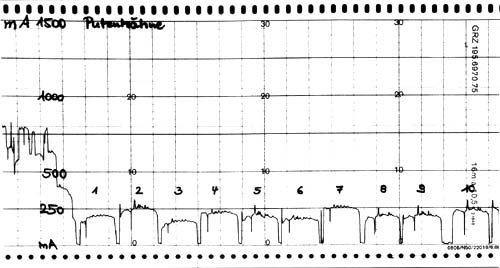
Die Betäubung im Wasserbad ist eine Ganzkörperdurchströmung. Da hierbei das Herz im Stromweg liegt, besteht bei Strömen, die nicht wesentlich von sinus 50 Hz abweichen, selbst bei niedrigen Stromstärken immer die Möglichkeit des Auftretens von Herzkammerflimmern (Darst. 5).
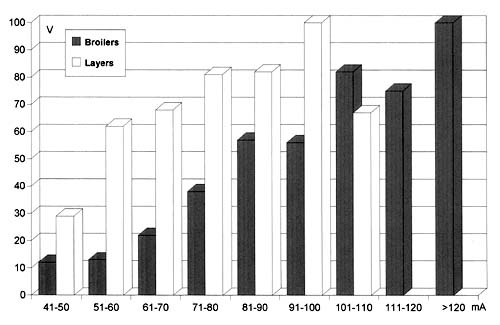

Die Betäubung im Wasserbad bedeutet eine Betäubung von Gruppen. Alle Vögel, die Kontakt mit dem Wasser und der metallenen Ableitstange haben, sind dem Stromfluss gleichzeitig ausgesetzt. Elektrotechnisch bedeutet dies eine Parallelschaltung der einzelnen Tiere. Da alle Tiere der gleichen Spannung ausgesetzt sind, hängt der Stromfluss, der durch ihren Körper geht, von ihrem jeweiligen individuellen Widerstand ab. Diese individuellen Stromstärken summieren sich zur Gesamtstromstärke, die vom Betäuber abgegeben wird.
Dieser Unterschied zur Betäubung von anderen Schlachttieren ist für die Überwachungsbehörde wichtig. Amperemeter, die an die elektrischen Betäubungsgeräte für Schweine angeschlossen sind, messen den Strom, der durch den Kopf des Tieres geht. Amperemeter, die an einen Wasserbadbetäuber für Geflügel angeschlossen sind, zeigen die Summe der individuellen Ströme an, die durch alle eingetauchten Tiere gleichzeitig fließen. Um die durch das einzelne Tier fließende Stromstärke einschätzen zu können, muss die angezeigte Gesamtstromstärke durch die Zahl der gleichzeitig eingetauchten Tiere geteilt werden.
Auch dann erhält man jedoch nur den Durchschnittswert der individuellen Stromstärke je Tier! Der Strom, der tatsächlich durch ein einzelnes Tier fließt, kann sowohl höher als auch niedriger liegen als der berechnete Durchschnittswert und nur aus der am Betäuber eingestellten Spannung und dem individuellen Widerstand des Einzeltieres berechnet werden. Letzterer setzt sich grob aus dem Innenwiderstand des Tieres, dem Hautwiderstand und dem Übergangswidertund zwischen Tier und Elektroden zusammen und bleibt dem Prüfer unbekannt.

Die für die wirksame Betäubung von Geflügel im Wasserbadbetäuber erforderliche Gesamtstromstärke kann errechnet werden, wenn man die Zahl der gleichzeitig eintauchenden Tiere mit der vorgeschriebenen Mindeststromstärke je Tier multipliziert. Die Spannung muss dann so eingestellt werden, dass diese Gesamtstromstärke auch unter Vollast, d.h. bei voller Beladung der Förderkette, aufrechterhalten wird:
Imin = Mindeststromstärke je Tier
n = Zahl der gleichzeitig eingetauchten Tiere
Itot = Gesamtstromstärke im Wasserbadbetäuber
Sofern man zu Beginn der Schlachtung nicht weiß, welche Spannung notwendig ist, um die geforderten Stromstärken zu erzielen, oder wie viele Tiere gleichzeitig eintauchen, kann man die ersten Tiere einer Charge einzeln durch den Betäuber schicken und die Spannung so einregeln, dass die Mindeststromstärke erreicht wird. Bei voller Beladung der Kette sinkt jedoch die Spannung unvermeidlicherweise ab, so dass man bei diesem Verfahren die Spannung umgehend nachkontrollieren und, wo erforderlich, nachregulieren muss.
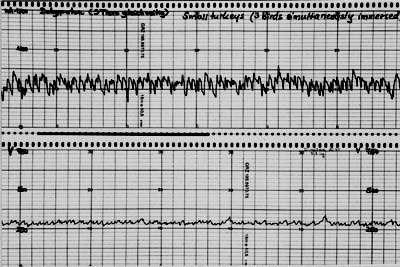
Die Aufzeichnung der von einem Wasserbadbetäuber während der Betäubung abgegebenen Stromstärken ergibt keine gerade Linie, sondern eine solche, die um die durchschnittliche Stromstärke oszilliert. Diese Schwankungen haben zwei Ursachen: zum einen die unterschiedlichen individuellen Widerstände der eintauchenden Tiere, durch die sich der Gesamtwiderstand ständig ändert, zum anderen die ständige Änderung der Zahl der gleichzeitig eingetauchten Tiere, die in den Wasserbadbetäuber nicht streng synchron eintreten und ihn wieder verlassen (Darst. 6).
Wenn man die Stromstärke überprüft, sollte man beachten, dass die meisten kommerziell erhältlichen Volt- und Amperemeter zum Messen der sinusförmigen Wechselströme von 50 Hz gebaut wurden. Um Stromstärken bei hiervon abweichenden Stromformen und Stromfrequenzen korrekt messen zu können, sind kompliziertere Geräte erforderlich. Darüber hinaus muss sichergestellt sein, dass der gemessene Strom tatsächlich zwischen den dafür vorgesehenen Elektroden geflossen ist, d.h., zwischen Wasserbad und Schlachtbügel, und nicht - wie bei fehlerhafter Isolierung oder anderen Leckströmen möglich - über sekundäre Verbindungen innerhalb der Betäubungsanlage. Wenn das Amperemeter einen Stromfluss anzeigt, ohne dass sich ein Tier im Betäuber befindet, sollten die Ursachen der Leckströme identifiziert und abgestellt werden. Es empfiehlt sich in jedem Fall, einen kompetenten technischen Sachverständigen bei der Überprüfung der Betäubungseinrichtung heranzuziehen.
Elektrische Betäubungseinrichtungen einschließlich der Wasserbadbetäuber wurden vom Internationalen Elektrotechnischen Komitee (IEC) genormt. Die internationale Norm gilt seit dem 1. Januar 1999 auch als DIN/EN 60335-2-87:1999 und kann von den nationalen Normungsorganisationen der Mitgliedstaaten (in Deutschland dem DIN) bezogen werden, die auch Übersetzungen vornehmen. Diese Industrienormen zielen auf die Gewährleistung der Anwendersicherheit, sollen aber auch das bestimmungsgemäße Funktionieren unter verschiedensten Praxisbedingungen sicherstellen.

Der innere Körperwiderstand der Tiere kann nicht beeinflusst werden. Von wesentlich größerer praktischer Bedeutung ist jedoch der Übergangswiderstand zwischen Tier und Elektroden. Dieser sollte durch geeignete Maßnahmen so weit wie möglich reduziert werden.

Während der Kontakt zwischen dem Kopf des Tieres und dem Wasser ausgedehnt ist und kaum zum Übergangswiderstand zwischen Tier und Einrichtung beiträgt, ist ein guter Kontakt zwischen den Ständern und dem Schlachtbügel von großer Bedeutung. Ein hoher Übergangswiderstand, der durch lose sitzende Schlachtbügel, verschmutzte Ständer oder deren trockene Hornschuppen verursacht wird, kann die Stromstärke unter den für das Auslösen einer wirksamen Betäubung erforderlichen Schwellenwert drücken (Darst. 7). Einige Tropfen Wasser auf die Kontaktstelle gesprüht reduzieren diesen Übergangswiderstand drastisch. In einigen Betrieben kann es bereits reichen, die Tiere in Schlachtbügel einzuhängen, die noch von der vorhergehenden Reinigung tropfend nass sind. Daher fordert die Richtlinie 93/119/EC, den Kontaktbereich zwischen Beinen und Schlachtbügel anzufeuchten (Anhang C II 3. B. Nr. 3). Man muss allerdings aufpassen, wo und wie man das Wasser einsetzt. In einer Putenschlachterei wurden die Beine der Tiere unmittelbar vor dem Eingang in den Betäuber durch einen Wasserstrahl befeuchtet. Dies schreckte die Tiere auf, die dann manchmal in Flügelschlagen ausbrachen, was zum verspäteten Eintauchen führte.
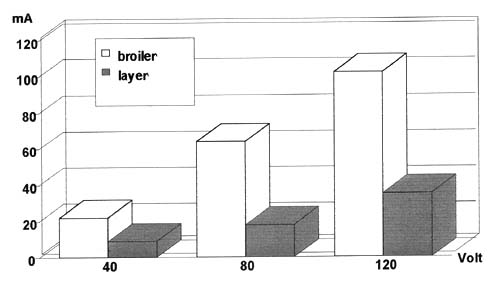
Nicht nur ein unzureichender Kontakt zwischen Beinen und Schlachtbügel, sondern auch eine schlechte Einstellung der metallenen Ableitstange, an der die Schlachtbügel während der Passage durch den Betäuber entlangschleifen, kann den Übergangswiderstand merklich erhöhen: in einem Putenschlachtbetrieb konnten wir einmal beobachten, dass nicht die Schlachtbügel, sondern die Beine der Tiere die Ableitstange entlangschleiften. Die Stromdichte an der Kontaktstelle war so hoch, dass an etlichen der Beine Verbrennungen erkennbar wurden. Nachfolgende Experimente in Gänsen belegten, dass unter diesen Bedingungen die individuelle Stromstärke um 50% und mehr reduziert sein konnte (Schütt-Abraham et al., 1992). Wenn man die Tiere in die Schlachtbügel hineinrammt, kann das den Übergangswiderstand drastisch reduzieren, indem Hornschuppen abgestreift und die Haut verletzt wird, allerdings ist das Benetzen der Kontaktstelle mit dem Blut der Tiere ein tierschutzwidriges Verfahren.

Wasser leitet den elektrischen Strom ziemlich gut. Seine eigener spezifischer elektrischer Widerstand hängt von der Menge gelöster Ionen ab. Das Ansalzen des Wassers wäre ein einfaches Mittel, um seinen spezifischen Widerstand zu senken, aber es würde auch die Umwelt kontaminieren, und ist zudem ganz überflüssig. Experimente haben gezeigt, dass, solange der Abstand zwischen der stromzuführenden Elektrode und dem Kopf des Tieres gering gehalten wird (<20 cm) der Abfall der Spannung zwischen Elektrode und dem Kopf des Geflügels, der dem spezifischen Widerstand des Wassers zuzuschreiben ist, vernachlässigbar ist (Schütt-Abraham et al., 1991). Wegen des ständigen Schmutzeintrags in das Wassers durch die passierenden Tiere steigt die Leitfähigkeit des Wassers sowieso.
Anstatt eine Salzlösung zu verwenden, sollte besser die Konstruktion des Wasserbades dafür sorgen, dass der Kopf der Tiere an jedem Punkt der Passage nie mehr als 20 cm von der unter Spannung stehenden Elektrode entfernt ist. Aus diesem Grund fordert die Richtlinie, dass die stromführende Elektrode sich über die gesamte Länge des Wasserbades erstrecken muss (Annex C II Nr. 3 Abs.B Nr. 4). Eine Elektrode, die den Boden des Troges bedeckt, wäre eine optimale Lösung, weil bei ihr der Kopf automatisch im Stromweg läge.

Eine elektrische Betäubung mit den oben genannten Stromstärken führt zu sofortiger und anhaltender Bewußtlosigkeit bei Geflügel. Das Verfahren als solches ist daher tierschutzgerecht. Leider hat der Wasserbadbetäuber auch einige Nachteile in bezug auf den Tierschutz: die Vögel müssen vorher in die Schlachtbügel eingehängt werden, das Eintauchen der Köpfe kann in einigen Fällen nicht garantiert werden, und es können vorzeitige Stromstöße erfolgen.

Geflügel ist vom grundsätzlichen Verbot der Richtlinie, Tiere vor der Schlachtung an ihren Beinen aufzuhängen, ausgenommen (Anhang B No. 2). Das Aufhängen von Geflügel vor der Betäubung wird jedoch kürzlich aus Tierschutzgründen wegen der damit verbundenen Belastung der Tiere kritisiert (Sparrey und Kettlewell, 1994). Dies wurde aus den bedeutenden Zunahmen der Herzfrequenz und der Atemfrequenz nach dem Einhängen geschlossen (Zeller et al., 1989). Herzfrequenzen über 350 Schlägen pro Minute, die in aufgehängtem Geflügel üblich sind, wurden jedoch auch bei anaesthesiertem aufgehängten Geflügel beobachtet (Richards und Sykes, 1967). Darüber hinaus wurden vergleichbare Anstiege der Herzfrequenz in anaesthesierten, d.h. bewußtlosen Hühnern beobachtet, wenn ihre Position von normaler Haltung zu kopfüber geändert wurde und zurück, wobei Kneifen keinen cardialen Schmerzreflex auslöste (Darst. 8). Diese Veränderungen waren erheblich kleiner als bei wachen Hühnern, jedoch könnte dies seine Ursache auch in der generellen Erniedrigung der Herzfrequenz durch die verwendete Kombinationsnarkose haben (Rompun ® / Nembutal ®).
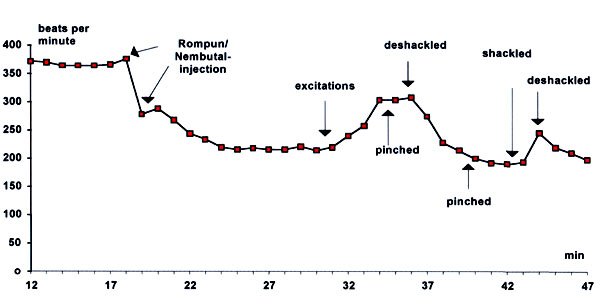
Obwohl die berichteten Befunde in anaesthesierten Hühnern die Vermutung nahe legen, dass die Erhöhung der Herzfrequenz nach Einhängen eine reflektorische Antwort auf die Positionsänderung und damit nicht notwendigerweise ein Zeichen angstbedingter Belastung ist, schließen sie letztere nicht aus. Das Umdrehen führte darüber hinaus bei Broilern zu höheren Cortisolkonzentrationen als der Umgang mit Broilern in aufrechter Position, auch wenn dieser Effekt vom Einsetzen in die Transportkäfige überlagert wurde (Kannan und Mench, 1996).
Nicht nur die umgekehrte Position, sondern auch das Gewicht der Tiere, das an den Beinen zieht, gibt zu Bedenken Anlass, insbesondere bei schweren Tieren (Putenhähne können bis zu 25 kg wiegen) oder solchen mit Beinschwächen. Einem Survey zufolge waren 90% der Broiler aus intensiv aufgezogenen Herden von erkennbaren, 26% von schweren Beinanomalien betroffen (Kestin et al., 1992). Es ist auch diskutiert worden, ob stramm sitzende Schlachtbügel, welche die Beine eindrücken, als schmerzhaft empfunden würden. Diese Vermutung wird von der Beobachtung gestützt, dass die Amplitude der SEP in eingehängten Hühnern gegenüber frei stehenden Tieren wesentlich reduziert war (Gregory und Wotton, 1989).
Obwohl angesichts dieser Bedenken die Zeit, für welche die Tiere in der invertierten Position eingehängt sind, so kurz wie möglich gehalten werden sollte, muss man den Tieren ein wenig Zeit lassen, damit sie sich beruhigen und aufhören, mit den Flügeln zu schlagen, bevor sie in den Betäuber eintreten. Als Beruhigungsstrecke werden 12 sec für Hühner empfohlen (Gregory und Bell, 1987). 3 min sind in Deutschlund und dem Vereinigten Königreich rechtlich zulässig. Zu Beginn unserer Experimente hielten wir Legehennen bis zu 60 Minuten ohne erkennbare Probleme in eingehängter Position, während Puten dazu neigten, Kreislaufprobleme zu bekommen, wenn sie nur 7 Minuten lang eingehängt waren. In einem Putenschlachtbetrieb, in dem die Tiere eine sehr lange Distanz vom Entladen und Einhängen bis zum Betäuber zurücklegen mussten, erschienen viele der Hähne bereits halb komatös, wenn sie in den Wasserbetäuber eintraten. In einem anderen Schlachtbetrieb wurden Puten abwechselnd von der betäubernahen und betäuberfernen Seite eines LKW in das um diesen laufende Bund eingehängt. Am Betäubereingang konnte man bei genauem Hinsehen ein alternierendes Bild von rosa und bläulichen Köpfen sehen, die diese Tatsache wiederspiegelten, obwohl das längste Intervall zwischen Einhang und Betäuben 5 Minuten nicht überstieg (BgVV, unveröffentlicht).

Vorzeitige Stromstöße stellen ein bedeutendes Tierschutzproblem dar. Sie können aus vielerlei Gründen auftreten. Meist sind sie durch überfließendes, unter Spannung stehendes Wasser oder die Körperhaltung der Tiere bedingt.

Am Eingang in den Wasserbadbetäuber können auch Tiere, die bis dahin ruhig gehangen haben, plötzlich anfangen zu flattern. Dies wird oft durch überfließendes, unter Spannung stehendes Wasser verursacht, das intermittierend schmerzhafte Stromstöße an die ankommenden Tiere weitergibt.
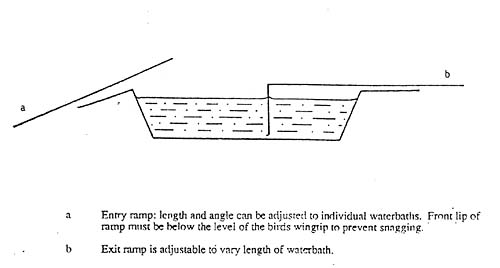
Um dies zu verhindern, schreibt die Richtlinie vor, dass der Betäuber so gestaltet sein muss, dass jeder Kontakt zwischen dem eintretenden Vogel und dem überfließenden Wasser ausgeschlossen ist (Anhang C II. 3. B. Nr. 4). Dies kann dadurch erreicht werden, dass der Betäubereingang mit einer zweiten (trockenen) Rampe überdeckt wird (Thomas, 1990; Wotton und Gregory, 1991), oder indem ein Überlauf in einer weniger ungünstigen Position, z.B. an der Austrittsseite oder deutlich unterhalb des Betäubereingangs angelegt wird (Darst. 9).

Eingehängte Puten pflegen ihre Hälse mehr oder weniger horizontal ausgestreckt zu halten, während ihre Flügel herabhängen. Dadurch erfolgt bei der konventionellen Seitwärtspassage des Betäubungsbeckens der erste Kontakt mit dem unter Spannung stehenden Wasser durch den vorangehenden Flügel. Der Stromschlag löst heftiges Flügelschlagen aus, was zu unterbrochenem und offenkundig schmerzhaftem Stromkontakt für bis zu 10 Sekunden führt (Darst. 10). Erst dann taucht der Kopf des Tieres endlich ein und die Betäubung erfolgt (BGA, 1990; Knauer-Kraetzl, 1991). Das Absenken der Schlachtlinie über dem Wasser kann dieses Flügelschlagen bedeutend reduzieren (je nach der Bandgeschwindigkeit), aber nicht endgültig beseitigen, da immer noch die Flügel das Wasser zuerst berühren. Eine Umgestaltung des Eintrittsbereiches scheint der einzige Weg, dieses Problem zu lösen.
In einem Betrieb ragte eine metallene Rampe über den Betäubereingang und führte zum Stromkontakt mit den unbefiederten Teilen der Putenköpfe. Ein Kontakt der Flügel mit dieser unter Spannung stehenden Rampe führt in einem vollbefiederten Tier selten zum Stromfluss, da trockenes Gefieder eine sehr gute Isolationswirkung hat (Schütt-Abraham et al., 1992). Die Tiere tauchten wegen des durch den Strom bedingten tonischen Krampfes mit an den Körper gezogenen Flügeln und dem Kopf zuerst ins Wasser. Stromstärkeaufzeichnungen bei einzelnen Tieren zeigten unter diesen Bedingungen eine Stromspitze infolge des Kopf-Metallrampen-Kontakts gefolgt von einem Plateau nach Eintauchen des Tieres (Darst. 11). Diese Gestaltung funktionierte erstaunlich gut mit Putenhähnen. Putenhennen fingen demgegenüber häufig an, mit den Flügeln zu schlagen. Wegen ihres höheren Übergangswiderstandes waren die Anfangsstromstärken geringer und reichten vermutlich nicht aus, einen sofortigen epileptischen Anfall auszulösen (BGA, 1990).
Auch eine nicht unter Spannung stehende Rampe wurde konstruiert, um die Flügel so lange trocken zu halten, bis die Tiere mit dem Kopf voran ins Wasser plumpsten (Wotton und Gregory, 1991).
In einem anderen Schlachtbetrieb fanden wir die Puten so dicht aneinander gehängt, dass nur wenige hinreichend Platz hatten, um mit den Flügeln zu schlagen oder sie herunter hängen zu lassen. Sehr selten wurde Flügelschlagen beim Betäubereingang beobachtet.

Unvollständiges oder verzögertes Eintauchen der Köpfe kann gelegentlich bei allen Geflügelarten vorkommen, insbesondere, wenn die Tiere aufgeregt werden und dann den Kopf heben oder in Flügelschlagen ausbrechen. Es scheint aber ein besonderes Problem bei Wassergeflügel zu sein.
Enten gehen oft so durch den Betäuber, dass nur ihre Schnäbel und Kehlen eingetaucht sind. Da Augen und Hirnschädel aus dem Wasser herausragen könnte ein bedeutender Teil des Stromes am Gehirn vorbeifließen. Untersuchungen haben tatsächlich ergeben, dass bei unvollständigem Eintauchen mit einer weniger anhaltenden Betäubung zu rechnen ist. So hatten nur 20% der Enten, deren Köpfe ganz eingetaucht waren, nach dem Stromfluss erhaltene VEP. Dieser Anteil erhöhte sich auf 70% bei unvollständigem Eintauchen (Gregory und Wotton, 1992).
Gänse brechen oft in Kopfheben und Flügelschlagen aus, insbesondere, wenn sie über die Transportkäfige gezogen werden oder den Betäubereingang berühren. Dank ihrer langen und beweglichen Hälse sind Gänse in der Lage, ihren Kopf vollständig vor dem Eintauchen zu bewahren. In diesem Fall führt die resultierende Hals-Bein-Durchströmung zu Herzkammerflimmern bei vollem Bewusstsein. Obwohl wir in Berlin etliche verschiedene Konstruktionsänderungen am Betäuber - einschließlich der Verwendung von Trichtern - ausprobierten, konnte das Eintauchen der Köpfe nur verbessert werden, wenn die Gänse über den Betäubereingang hinweggehoben wurden und dann die Schlachtlinie über dem Wasser abgesenkt wurde (Knauer-Kraetzl et al., 1992).
In vielen Ländern werden Gänse nur saisonal geschlachtet, so dass man aus wirtschaftlichen Gründen mit den existierenden Schlachteinrichtungen für anderes Geflügel auskommen muss. Wasserbäder, die für Hühner bestimmt sind, erlauben es Gänsen (und großen Puten) jedoch, ihre Flügel gegen die Seitenwände zu pressen und sich so über das Wasser zu heben (BGA, 1990; Knauer-Kraetzl, 1991). Die Richtlinie fordert daher, dass das Wasserbad in Größe und Tiefe den zu betäubenden Tieren angepasst sein muss (Anhang C II 3. B Nr. 4).
Es gibt immer die Möglichkeit, dass gelegentlich ein Tier dem Eintauchen entkommt. Daher ist eine Nachkontrolle in jedem Fall erforderlich. Sie wird auch von der Richtlinie gefordert (Anhang C II 3. B Nr. 5).

Geflügel, das Herzkammerflimmern bekommt, erholt sich in der Regel nicht. Es würe daher aus Tierschutzgründen nicht unbedingt erforderlich, sie zu entbluten. Dies gilt jedoch nicht für Puten und Gänse, die erheblich länger brauchen, bis sie ins Koma fallen. Da niemand einen 100%igen Tötungserfolg unter kommerziellen Schlachtbedingungen garantieren kann, sollten alle Tiere sofort entblutet werden, zumindest innerhalb 15-20 Sekunden nach dem Beginn des Stromflusses. Um eine rasche und optimale Ausblutung zu erzielen, sollten beide Halsschlagadern und die Jugularvenen durchtrennt werden. Bei Tieren ohne Kammerflimmern sowie bei Puten und Gänsen ist das sofortige Durchtrennen beider Halsschlagadern das einzige Mittel, um zu verhindern, dass die Gehirnfunktionen auch nur teilweise zurückkehren (Gregory und Wotton, 1986) und wird daher auch vom SVC (1997) dringend empfohlen.

Wie Schlachtvieh kann auch Schlachtgeflügel durch alleinige Kopfdurchströmung mit einer Betäubungszange betäubt werden. Kopfdurchströmung bei 90 V führt bei Hühnern zu einem epileptischen Anfall, dessen isoelektrische Phase durchschnittlich mindestens 36 sec dauerte (Richards und Sykes, 1967). Bitemporales Anlegen einer Spannung von 100 - 120 Volt für >1 sec führte bei Hühnern zu Stromstärken von 400 mA und mehr (Fricker, 1974; Gregory und Wotton, 1990b; Wormuth et al., 1981), gleiches gilt für Puten (Gregory und Wotton, 1991b). Mit Stromstärken von 400 mA hielt die elektrische Stille nach dem epileptischen Anfall mindestens 30 Sekunden nach dem Beginn des Stromflusses an (Fricker, 1974; Wormuth et al., 1981), in einigen Fällen sogar bis zu 2 min (Fricker, 1974). Die Stromstärken führten zu einem sofortigen Verlust evozierter Potentiale (22, 31). Darüber hinaus erlaubt die Methode eine individuelle Zumessung der Stromstärke und führt deshalb zu einer gleichmäßigeren Betäubung. Um den korrekten Elektrodenansatz sicherzustellen müssen die Köpfe der Tiere gut fixiert sein.
V-förmige Elektroden, in welche die Tiere bei kleineren Schlachtzahlen mit den Köfen eingehängt werden, um eine Kopfdurchströmung zu bewirken, sind bereits kommerziell erhältlich. Da die Spannungen für den Anwender eine Gefahr darstellen, werden die Tiere mit den Köpfen in das V gehängt und erst dann ein Knopf gedrückt, um die Spannung zuzuschalten. Infolge des Gewichts der Tiere werden die Köpfe in das V hineingezogen und bekommen so einen guten Elektrodenkontakt. Wenn die Tiere nach der Betäubung in einen Schlachttrichter gehängt und entblutet werden, zeigen nur wenige Zeichen wiederkehrenden Bewusstseins. Dennoch scheinen die ersten Sekunden, an denen die Tiere an ihren Köpfen aufgehängt sind, eine bei weitem größere Belastung zu sein als das normale Einhangverfahren.
Da Herzkammerflimmern bei diesem Verfahren nicht auftritt, muss innerhalb 10-15 sec unter Durchtrennung beider Halsschlagadern entblutet werden (Gregory und Wotton, 1990b; Gregory und Wotton, 1991b). Jedoch kommt es zu einem klonischen Krampf mit heftigem Flügelschlagen, wodurch das rasche Entbluten behindert werden kann. Die Tiere könnten aber in Schlachttrichtern fixiert werden (Hillebrand et al., 1996) oder durch einen Stromstoß länges der Wirbelsäule immobilisiert werden. Bei einer kombinierten Kopf/Ganzkörperdurchströmung von Legehennen flossen nach Anlegen einer Spannung von 140 - 220 V an den Kopf und einer zusätzlichen Elektrode an den Beinen 3/4 der Gesamtstromstärke durch den Kopf und 1/4 durch den Körper (Wormuth et al., 1981). Zuverlässige automatische Anlagen zur Kopfdurchströmung sind kommerziell allerdings nicht verfügbar, obwohl bereits verschiedene Prototypen in unterschiedlichen Stadien der Entwicklung unter praktischen Bedingungen getestet wurden.

Korrekt angewendete Elektrobetäubung ist ein einfaches und sehr wirksames Verfahren zur Betäubung von Schlachtgeflügel. Jedoch hat das Verfahren Nebenwirkungen, welche die Schlachtkörperqualität nachteilig beeinflussen können. Da kommerzielle Schlachtbetriebe dazu neigen, stets zuerst die Elektrobetäubung für Probleme mit der Produktqualität verantwortlich machen, sollte man imstande sein, Wahres vom Falschen zu trennen. Elektrobetäubung kann bestimmte Knochenbrüche und Blutungen fördern, aber sie beeinträchtigt nicht den Ausblutungsgrad oder führt gar zu "explodierenden" Organen. Darüber hinaus können auch die Herkunft des Schlachtgeflügels, die Aufzucht- und Mastbedingungen, die Kondition der Tiere, das Einfangen, Einsetzen in Transportkäfige und den Transport zum Schlachtbetrieb, das Entnehmen aus den Transportkäfigen, das Einhängen, das Entbluteverfahren, den Brüh- und Rupfprozess und weitere Faktoren bei der Ausbildung von Schlachtschäden eine Rolle spielen.

Wasserbadbetäubung bedeutet eine Ganzkörperdurchströmung, bei der Gehirn und Herz im Stromweg liegen. Selbst bei niedrigen Stromstärken um 45 mA (sinus 50 Hz) bekommen bereits etwa 10 % der Tiere Herzkammerflimmern (Darst. 5), (Wormuth et al., 1981). Der traditionelle Glaube, dass Tiere mit Herzkammerflimmern, das funktionell einem Herzstillstand gleichkommt, schlecht ausbluten, ist seit langem durch wissenschaftliche Untersuchungen widerlegt. Unter der Voraussetzung, dass bei den Tieren umgehend ein korrekter Entblutungsschnitt durchgeführt wird, bluten Tiere mit Kammerflimmern ebenso vollständig aus wie Tiere mit erhaltener Herzaktion (Darst. 12).
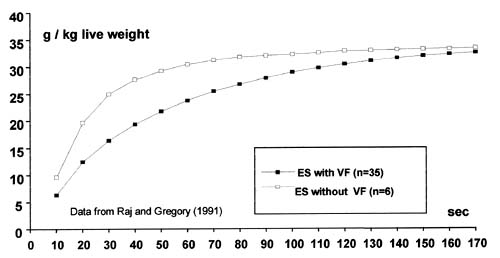
Allerdings erfolgt die Ausblutung langsamer, wenn das Herz nicht mehr schlägt, so dass Vergleiche zwischen Tieren mit und ohne Herzkammerflimmern innerhalb der ersten 90 Sekunden der Ausblutung einen signifikanten Unterschied im Blutverlust aufzeigen können (BGA, 1990; Raj und Gregory, 1991; Schütt, 1982). Dennoch ist der Ausblutungsgrad insgesamt nicht beeinträchtigt, und der Gesamtblutverlust liegt innerhalb der Spannweite, die bei Tieren ohne Herzkammerflimmern oder mit Gas betäubten Tieren zu beobachten ist (Darst. 13) (Ali et al., 1995; BGA, 1990; Dickens und Lyon, 1993; Fricker und Müller, 1981; Gregory und Wilkins, 1989; Griffiths et al., 1985; Knauer-Kraetzl, 1991; Papinaho und Fletcher, 1995; Raj und Gregory, 1991; Schütt, 1982; Weise et al., 1982). Auch wurde weder ein Unterschied im Blutverlust zwischen mit 50 Hz (und Herzkammerflimmern) oder 1500 Hz (Herzkammerflimmern ausgeschlossen) betäubten Tieren gefunden (Raj et al., 1997), noch zwischen Hühnern, die mit 50, 100, 150 or 200 mA (und entsprechenden Zunahmen des Anteils von Tieren mit Herzkammerflimmern) (Papinaho und Fletcher, 1995) betäubt wurden. Der Restblutgehalt in der Muskulatur durch elektrischen Strom getöteter und entbluteter Hühner lag im selben Bereich wie der nach reversibler Betäubung entbluteten Tieren (Griffiths et al., 1985).

Die signifikanten Unterschiede nicht nur in der Ausblutungsgeschwindigkeit, sondern auch im Gesamtblutverlust bei Puten, die nach einseitigem Halsschnitt auftraten und dem Herzstillstand zugeschrieben wurden (Mouchoniere et al., 1999) weisen tatsächlich eher auf die Bedeutung des Durchtrennens beider Halsschlagadern hin, die erforderlich ist, um eine gute Entblutung zu erzielen. In unseren eigenen Untersuchungen führten wir einen seitlichen Stich aus, der beide Halsschlagadern und wenigstens eine Jugularvene durchtrennte. Mit diesem Entblutungsverfahren ergaben sich bei Babyputen, Putenhennen und Putenhähnen keine Unterschiede im Blutverlust (bezogen aufs Lebendgewicht) zwischen mit und ohne Herzkammerflimmern betäubten Tieren (Knauer-Kraetzl, 1991).
Um eine rasche und vollständige Ausblutung zu erzielen, sollten beide Halsschlagadern und beide Jugularvenen durchtrennt werden (SVC, 1997). Wenn das Geflügel von Hand entblutet wird, hängt die Wirksamkeit des Entblutungsschnittes vom Geschick des Entblutepersonals und dem Verhalten der Tiere ab. So fanden wir in einem Putenschlachtbetrieb bei nahezu allen Tieren beide Halsschlagadern durchtrennt, während die Jugularvenen bei 63% der Putenhähne, aber nur bei 5 % der getrennt von den Hähnen geschlachteten Putenhennen beiseits durchtrennt worden waren. Ein Grund für diesen Unterschied in der Schnittführung zwischen Putenhähnen und -hennen war auf den ersten Blick nicht ersichtlich, da der Halsschnitt bei beiden Geschlechtern vom selben Entbluter ausgeführt wurde.
Die Entblutung wurde unmittelbar nach dem Austritt der Tiere aus dem Betäuber an einer U-Kehre des Schlachtbandes vorgenommen. Beobachtungen ergaben, dass die Hähne beim Austritt aus dem Wasserbad relativ ruhig hingen. Ihre Hälse konnten daher leicht ergriffen und der Stich bereits ausgeführt werden, während sie sich noch auf den Entbluter zubewegten. Demgegenüber verließen die Hennen den Betäuber oft flügelschlagend und erschwerten es dadurch dem Entbluter, ihre Hälse zu ergreifen. Infolgedessen verzögerte sich der Schnitt bei den Hennen und wurde häufig erst ausgeführt, wenn sich die Tiere schon wieder vom Entbluter fort bewegten. Diese Erklärung wurde durch die Feststellung gestützt, dass in allen Hähnen, bei denen nur eine der beiden Jugularvenen durchtrennt war, diese stets auf derselben Seite durchtrennt war, während sich bei den Hennen linksseitig und rechtsseitig durchtrennte Jugularvenen etwa die Waage hielten.
Eine korrekte Entblutung sollte zwingend bei allen Schlachttieren erfolgen. Wenn Tiere mit Herzkammerflimmern nicht korrekt oder gar nicht entblutet werden, kann das Blut schon zum Zeitpunkt des Austritts aus dem Rupfer aus den oberen Körperpartien in die unteren versackt sein. Die unten hängende Hälfte des Schlachtkörpers erscheint dann rot verfärbt, während die obere eine normal blasse Hautfarbe zeigt. Diese Verfärbung betrifft insbesondere die Hälse, Flügel und die Federfluren über der Brust (Gregory und Wilkins, 1989d). Jedoch scheinen auch andere Faktoren dazu beizutragen, da anderen Untersuchungen zufolge sich durch die Elektrobetäubung getötete, aber nicht entblutete Hühner optisch nicht von den normal entbluteten unterschieden (Griffiths, 1985; Heath et al., 1983).
Die rote Verfärbung der unteren Hälfte normal hergerichteter, aber nicht entbluteter Tiere muss von den sogenannten "Redskins" (Rothäuten) unterschieden werden, bei denen der gesamte Schlachtkörper leuchtend rot verfärbt ist. Redskins scheinen durch eine entzündliche Reaktion der Haut verursacht zu werden, die entsteht, wenn nicht-fibrillierende Tiere versehentlich nicht entblutet werden und dann lebend in das Brühwasser geraten(Griffiths, 1985; Heath et al., 1983).

Von allen Schlachtschäden, die der elektrischen Betäubung zugeschrieben werden, wurde nur bei Knochenbrüchen im Schultergürtel und Blutungen in der Brustmuskulatur zweifelsfrei nachgewiesen, dass sie vorwiegend der Elektrobetäubung zuzuschreiben sind. Während diese Schlachtschäden zu Zeiten der Vermarktung von ganzem Gefriergeflügel kein Problem darstellten, weil sie äußerlich am Schlachtkörper nicht zu erkennen waren, wird heute ein bedeutender Teil des Geflügels zerlegt vermarktet. Muskelblutungen werden daher vom Abnehmer leicht entdeckt, und Zurückweisungen führen zu wirtschaftlichen Verlusten.

Mit Beginn des Stromflusses kommt es zu einer sofortigen und maximalen Kontraktion der gesamten Skelettmuskulatur. Dieser schlagartig einsetzende Starrkrampf kann zu Knochenbrüchen im Schultergürtel führen. Bei der im Labor vergleichsweise herrschenden Ruhe kann man sogar die Knochen in dem Augenblick brechen hören, in dem der Vogel starr wird. Brüche der Schultergürtelknochen kommen besonders bei stark bemuskeltem Geflügel wie Puten oder Broilern vor, oder bei Geflügel mit extrem zerbrechlichen Knochen, wie sie Legehennen am Ende der Legeperiode oft aufweisen. In Enten oder Gänsen sind solche Knochenbrüche vergleichsweise selten. In unseren eigenen Experimenten beobachteten wir nicht einen einzigen (BGA, 1990; Knauer-Kraetzl, 1991), obwohl von Knochenbrüchen bei Enten in der Literatur berichtet wird (Gregory und Wilkins, 1990).
Während die Stromstärken, die für eine Betäubung notwendig sind, für ein allgemein erhöhtes Vorkommen von Knochenbrüchen verantwortlich gemacht werden, sind die Untersuchungsergebnisse zu diesem Punkt widersprüchlich. In einer dänischen Studie an Broilern, die 0, 50, 100 oder 200 V (50 Hz Wechselstrom) ausgesetzt wurden, erhöhte sich der Anteil von Tieren mit Knochenbrüchen von 7 auf 21 %, nachdem die Spannung von 50 auf 200 V heraufgesetzt wurde. Allerdings führte der Durchgang der Tiere durch den ausgeschalteten Betäuber, d.h., ohne dass überhaupt ein Strom durch die Tiere floss, zur höchsten Knochenbruchrate von 25%, wahrscheinlich aufgrund des heftigen Flügelschlagens, das im stromlosen Betäuber einsetzte. Da das Flügelschlagen im Falle eines Stromflusses durch die Muskelverkrampfung unterbunden wurde, nahm der Anteil gebrochener Flügel oder Beine mit zunehmender Betäubungsspannung sogar ab (Ali et al., 1995). Darüber hinaus wurde in dieser Untersuchung Knochenbrüche hauptsächlich in den Schlüsselbeinen beobachtet, während das Schulterblatt und das Rabenschnabelbein bei allen Tieren heil blieb. Britische Untersuchungen ermittelten demgegenüber im selben Spannungsbereich einen ebenso hohen oder höheren Anteil gebrochener Schulterblätter als gebrochener Schlüsselbeine (Gregory und Wilkins, 1990d). In einer amerikanischen Untersuchung, in der 200 V und 50 V Wechselstrom an insgesamt 72 Hühnern im Wasserbadbetäuber überprüft wurden, traten Knochenbrüche nur bei 2 der mit 50 V durchströmten Tiere auf (Dickens und Lyon, 1993). Bei Enten kam es mit höheren Stromstärken sogar eher zu einer Abnahme des Anteils gebrochener Rabenschnabelbeine (Gregory und Wilkins, 1990).
In einem anderen Versuch war das Vorkommen von Knochenbrüchen im Schultergürtel allgemein niedrig und erhöhte sich nicht, als die Stromstärke von 75 auf 250 mA je Tier angehoben wurde (Gregory und Wilkins, 1989c). Zudem legt die große Spannbreite des Anteils von Knochenbrüchen, die unter vergleichbaren Betäubungsbedingungen in verschiedenen Schlachtbetrieben auftraten, die Annahme nahe, dass andere Faktoren bei der Förderung oder Vermeidung von Knochenbrüchen eine Rolle spielen müssen. Hierzu gehört offensichtlich auch eine bestimmte Anfälligkeit der Tiere selbst. Während bei Untersuchungen in unserem Labor rund 75% der schweren Putenhähne Knochenbrüche im Schultergürtel aufwiesen, führte die Anwendung derselben Stromstärke, Stromfrequenz und Stromform in einem gewerblichen Schlachtbetrieb nur bei 20% der Tiere zu solchen Knochenbrüchen(BGA, 1990).
Für ausgediente Legehennen, die mit Stromstärken von weniger als 100 mA (sinus 50 Hz Wechselstrom) durchströmt wurden, wurde ein Knochenbruchanteil von rund 70% angegeben. Dieser Anteil fiel auf 64% wenn die Stromstärken 100 mA überschritten. Stromfrequenzen von 1500 Hz reduzierten diesen Anteil weiter, allerdings nicht unter 54% (Gregory et al., 1990). Der Anteil von Tieren mit palpierbaren Knochenbrüchen im Schultergürtel betrug hingegen bei Zuchthennen nach dem Rupfen in einem gewerblichen Schlachtbetrieb nur 11% (BGA, 1990).
Bei Käfighennen kann bereits das Umsetzen aus dem Lege- in den Transportkäfig, die Entnahme daraus und das Einhängen ins Schlachtband in hohem Maße zum Auftreten von Knochenbrüchen im Schultergürtel führen. So palpierten wir bei 30% von Käfighennen schon vor dem Betäubereingang gebrochene Knochen im Schultergürtel (BGA, 1990), was eine gute Übereinstimmung mit den von Gregory und Wilkins (Gregory und Wilkins, 1989b) angegebenen 29% aufweist. Nach deren Untersuchungen konnte bereits das Entnehmen der Legehennen aus den Transportkäfigen und das Einhängen in die Schlachtbügel mit einer Knochenbruchrate von 44% verbunden sein.
Obwohl in Schlachtbetrieben häufig Änderungen der Stromform und Stromfrequenz vorgenommen werden, um Knochenbrüche zu vermeiden, konnten zwischen pulsierenden Gleichtrömen von 50, 200 und 350 Hz (Gregory et al., 1991) keine Unterschiede festgestellt werden. Unterschiede in der Stromform (phasenangeschnittene im Vergleich zur vollen Sinuswelle) hatten bei der Betäubung von Broilern nicht den gewünschten Effekt, die Knochenbruchrate zu senken, sondern erhöhten sie stattdessen (Gregory et al., 1995). Knochenbrüche bei Putenhähnen ließen sich in einem Schlachtbetrieb signifikant von 34 auf 20% reduzieren, nachdem die dort zur Durchströmung mit 150 mA je Tier verwendete Stromfrequenz von 108 Hz auf 50 Hz zurückgesetzt wurde (BGA, 1990). Der Einsatz von 1500 Hz statt 50 Hz reduzierte die Knochenbruchrate bei Legehennen nur von 64 auf 54% (Gregory et al., 1990).
Dass Knochenbrüche im Schultergürtel selten nach anderen Betäubungsverfahren gefunden werden, belegt, dass die Elektrobetäubung solche Frakturen verursacht. Jedoch sollten in Anbetracht der Widersprüche in den Ergebnissen der vielen hierzu veröffentlichten Untersuchungen hohe Knochenbruchvorkommen nicht automatisch und ausschließlich der Betäubung mit hohen Stromstärken bei niedrigen Frequenzen zurückgeführt werden.

Die elektrische Betäubung wurde auch für Vorkommen von Brustmuskelblutungen verantwortlich gemacht, die als solche auch bei gasbetäubtem (Raj und Whittington, 1990; Raj, 1994), bolzenschussbetäubtem (Hillebrand et al., 1996) oder beim Transport verendetem Geflügel gefunden wurden (Gregory und Wilkins, 1990b). Die Anfälligkeit gegenüber Blutungen wird zudem von Faktoren beeinflusst, die im pre-Harvest-Bereich liegen, wie z.B. die Aufzucht und die Kondition des Schlachtgeflügels. Weitere Ursachen können im Einfangen und dem Transport, der Entblutung und Weiterbehandlung liegen und somit in weiten Bereichen zwischen den verschiedenen Schlachtbetrieben, Schlachttagen, Schlachtchargen, Transportentfernungen und Herkunftsbetrieben schwanken. Zudem beeinflussen sich diese individuellen Faktoren gegenseitig. Die widersprüchlichen Ergebnisse der verschiedenen Untersuchungen überraschen insofern nicht.
Der Schweregrad von Brustmuskelblutungen hing von der Herkunft, dem Untersuchungstag und der Aufzuchttemperatur ab (Kranen et al., 1998). Bei einigen Schlachtchargen war die allgemeine Blutungsneigung bereits so hoch, dass Unterschiede in der Stromstärke und der Strommenge keine erkennbaren Auswirkungen mehr hatten (BGA, 1990; Weise et al., 1982).
Brustmuskelblutungen kommen bei Enten und Puten offenbar vorwiegend im kopfwärtigen Drittel des oberflächlichen und tiefen Brustmuskels vor (BGA, 1990; Gregory und Wilkins, 1989c; Knauer-Kraetzl, 1991). Sie scheinen in der dunkleren Muskulatur von Gänsen ein seltenes Ereignis und sind zudem schwieriger zu erkennen (BGA, 1990). In Enten fanden wir vorwiegend die linke Seite betroffen, was nicht erklärt werden konnte, da der Strom (sinus 50 Hz) in diesem Fall über beide Elektroden eines kopfhörerähnlichen Teils zugeführt worden war (BGA, 1990; Knauer-Kraetzl, 1991).
In Broilern hatte die Erhöhung der Stromstärke von 80 auf 115 mA je Tier wenig Auswirkungen auf das Vorkommen von Brustmuskelblutungen. Wurde der sinusförmige Wechselstrom jedoch angeschnitten, resultierte daraus eine höhere Rate von Brustmuskelblutungen (Gregory et al., 1995). Wenn man die durchschnittliche Stromstärke über den Bereich von 45 bis 220 mA führte, schien der Anteil von Blutungen in der tiefen Brustmuskulatur von Broilern zunächst zu-, dann abzunehmen. Blutungen in der oberflächlichen Brustmuskulatur wurden davon anscheinend nicht beeinflusst Gregory und Wilkins, 1989e). Bei Enten wurde nach Anheben der Stromstärke von 85 auf 250 mA kein Anstieg von Brustmuskelblutungen gefunden (Gregory und Wilkins, 1990). In Puten schienen Blutungen in der tiefen, aber nicht in der oberflächlichen Brustmuskulatur von der Stromstärke abzuhängen, wenn man die Stromstärke von 150 auf 250 mA je Tier anhob (Gregory und Wilkins, 1989c). Kein signifikanter Unterschied wurde in Broilern beim Anheben der Stromfrequenz von 50 Hz über 200 Hz auf 350 Hz gefunden (Gregory et al., 1991; Hillebrand et al., 1996). In Schlachtchargen mit allgemein hohem Anteil an mittelgradigen bis schweren Blutungen im Brustfilet konnte dieser Anteil von 70 auf 47% reduziert werden, wenn man den automatischen Nackenschnitt, der lediglich beide Vertebralarterien und eine Halsschlagader erfasste, durch einen ventralen Entblutungsschnitt ersetzte, der beide Halsschlagadern und Jugularvenen durchtrennte. Nur eine leichte Verringerung (von 21 auf 17%) war jedoch zu beobachten, wenn das Vorkommen von Blutpunkten allgemein niedrig war(Gregory et al., 1999).

Andere Schlachtschäden, die häufig der Elektrobetäubung zugeschrieben werden, wie rote Flügelspitzen oder Bürzel, rote Federfluren, Flügelblutungen oder Blutstau in den Flügelvenen wurden in einigen Untersuchungen als stromstärkeabhängig erkannt, während andere keinen Zusammenhang nachweisen konnten. Einige wurden mit dem Rupfen in Verbindung gebracht, insbesondere, wenn das Geflügel nicht hinreichend ausgeblutet wurde(Gregory und Wilkins, 1990b). In einigen Schlachtbetrieben traten diese Schlachtschäden nur gelegentlich auf, selbst wenn 150 V für die Betäubung von Schlachtgeflügel eingesetzt wurde(Weise et al., 1982).
Rote Flügelspitzen wurden bei Huhn und Pute mit Flügelschlagen in Verbindung gebracht, und das Vorkommen von Flügelblutungen stieg bei Puten auf mehr als das Doppelte, wenn der Entblutungsschnitt einseitig anstatt beidseitig ausgeführt wurde(Gregory, 1988; Gregory et al., 1989). Andere fanden bei einer visuellen Inspektion der Schlachtkörper keine Unterschiede zwischen den mit 200 oder 50 V Wechselstrom betäubten Tieren (Dickens und Lyon, 1993).
In Hühnern wurde zunächst ein Anstieg, dann ein Abfall in der Häufigkeit roter Flügelspitzen, Blutungen der Flügelvenen und des Schultergelenks berichtet. Die Häufigkeit von Schlachtschäden war am geringsten, wenn entweder weniger als 130 oder mehr als 190 mA je Tier zur Betäubung eingesetzt wurden(Gregory und Wilkins, 1989e). Im Vergleich zu unbetäubten Tieren traten rote Flügelspitzen und rote Federfluren deutlich häufiger bei 200 V auf, während Flügelvenen- und Schulterblutungen bei 100 V im Vergleich zu unbetäubten, mit 50 V betäubten und mit 200 V betäubten Hühnern einen Gipfel aufwiesen (Ali et al., 1995). Das Auslösen von Herzkammerflimmern bei Betäubung mit Strömen um 81 mA erhöhte das Vorkommen roter Flügelspitzen und von Blutungen im Ellenbogengelenk bei Hühnern, aber es waren keine anderen erkennbaren Auswirkungen des Herzkammerflimmerns auf das Herunterstufen der Schlachtkörperqualität festzustellen(Gregory und Wilkins, 1989d).
In Enten hing das Auftreten von roten Bürzeln, roten Flügelspitzen, Flügelblutungen, angestauten Flügelvenen und Beinmuskelblutungen im Breich 85 bis 250 mA nicht von der Stromstärke ab (Gregory und Wilkins, 1990b).
Die Betäubung von Puten mit 75, 150 oder 250 mA je Tier hatte keinen Einfluss auf das Auftreten des Anteils von Haut- und Muskelblutungen oder Blutstau in den Flügelvenen(Gregory und Wilkins, 1989c).
Kein Zusammenhang wurden zwischen der während der Betäubung gemessenen Stromstärke und dem Aufteten oder dem Schweregrad von Unterschenkelblutungen gefunden(Gregory und Wilkins, 1989e). Lambooij et al. (1999) zufolge war der Anteil von Blutungen in der Unterschenkelmuskulatur signifikant vermindert, wenn die Broiler in einem Schlachttrichter ruhiggestellt wurden, statt in Schlachtbügel eingehängt zu werden. In den USA wurden signifikant höhere Vorkommen schwerer Blutungen bei elektrisch betäubten im Gegensatz zu nicht betäubten Broilern gefunden (Walker et al., 1993).
In unseren eigenen Untersuchungen wurde keine Beziehung zwischen der Spannung (und der daraus resultierenden Stromstärke) und am unzerlegten Schlachtkörper sichtbaren Blutungen gefunden. Legehennen, Enten, Babyputen, Putenhennen und schwere Putenhähne wurden genau auf das Vorhandensein roter Flügelspitzen und Bürzel, Blutungen in der Brusthaut, angestauten Flügelvenen oder Blutergüssen in den Flügeln nach dem Einhängen, nach dem Betäuben, nach dem Brühen und nach dem Rupfen untersucht. Angestaute Flügelvenen und frische Flügelblutungen wurden bei rund 10% der Enten und Puten vor dem Betäuben entdeckt und mussten daher durch das Handling der Tiere verursacht worden sein. 15 bis 30 % der Puten zeigten zudem Flügelspitzenblutungen vor der Betäubung. Kein signifikanter Anstieg äußerlich erkennbarer Blutungen wurde bei der genauen Inspektion unmittelbar nach der Betäubung gefunden. Die notierten Schlachtschäden waren entweder bereits vor dem Betäuben vorhanden oder traten zuerst nach dem Rupfen in Erscheinung (BGA, 1990; Knauer-Kraetzl, 1991).
Dies steht in Übereinstimmung mit anderen Untersuchungen, welche die Rolle der Rupfbelastung beim Zustandekommen dieser Schlachtschäden belegten (Gregory und Wilkins, 1990b).
Aus diesen einander widersprechenden Ergebnissen kann der Schluss gezogen werden, dass Schäden an Geflügelschlachtkörpern wesentlich von der Anfälligkeit des Tieres und seiner Kondition zum Zeitpunkt der Schlachtung sowie seiner Behandlung vor der Schlachtung abhängen und von der Betäubung und der weiteren postmortalen Herrichtung lediglich gefördert werden. Insbesondere führt belastendes Rupfen schlecht ausgebluteter Tiere zu besonders schweren Schlachtblutungen. Angesichts dieser Beobachtung warnten Gregory und Wilkins, dass es unklug sei, die Betäubung für jeden Fall plötzlich auftretender Schlachtschäden verantwortlich zu machen (Gregory und Wilkins, 1990b).

Im Vergleich zum Rotfleisch verläuft der Fleischreifungsprozess bei Geflügel rasch und ist normalerweise innerhalb weniger Stunden abgeschlossen. Konditionen wie PSE oder DFD sind noch nicht wie bei Schwein und Rind ein allgegenwärtiges Problem. Nach jüngeren Untersuchungen scheint die Qualität von Geflügelfleisch als solche - gemessen am pH-Wert, der Zartheit, der Textur, der Farbe oder dem sensorischen Genusswert nach Kochen - ziemlich unabhängig von Stärke oder Dauer der verwendeten Ströme zu sein.
Im Vergleich zu unbetäubten Hühnern hemmte die Elektrobetäubung unmittelbar nach der Schlachtung die postmortale Glykolyse, wie aus höheren pH-Werten und niedrigeren R-Werten 15 Minuten nach der Schlachtung geschlossen werden konnte, hatte aber nach 24 Stunden keinen Einfluss mehr (Papinaho und Fletcher, 1995). Betäubungsstromstärken zwischen 0 und 200 mA beeinflussten die Geschwindigkeit, mit der sich der Rigor ausbildete, aber nicht die endgültige Qualität des Brustmuskelfleisches (Papinaho und Fletcher, 1995). 75 min nach der Schlachtung zeigten Hühner, die mit durchschnittlich 132 mA betäubt und getötet wurden, einen geringfügig, aber nicht signifikant höheren pH und niedrigere R-Werte als reversibel betäubte Hühner, und wiesen 75 min post mortem erhöhte Scherwerte im entbeinten Brustmuskel auf (Lyon und Dickens, 1993). Die Verlängerung der Durchströmungzeit von 5 auf 40 s bei 100 V Wechselspannung hatte keine signifikante Auswirkung auf die postmortale Rigorentwicklung oder die Fleischqualität (Papinaho und Fletcher, 1995b). Die Ergebnisse zeigten, dass die Wirkung der elektrischen Betäubung im Bereich des Rigor mortis zuvorderst auf der Unterbindung des Krämpfe im perimortalen Bereich zurückzuführen sein könnte (Papinaho et al., 1995).
Bis zu 4-6 Stunden nach der Schlachtung waren bei höheren Strömen die Scherwerte signifikant erhöht, aber zwischen elektroimmobilisierten (10.5 V / 500 Hz) und betäubten (125 mA / 50 Hz, 5 sec) Hühnern wurden 24 Stunden nach der Schlachtung keine signifikanten Unterschiede gefunden (Craig und Fletcher, 1997; Papinaho und Fletcher, 1996; Poole und Fletcher, 1998). Alles in allem hatte die Betäubung daher keine anhaltenden Auswirkungen auf die Scherwerte (Craig und Fletcher, 1997; Papinaho und Fletcher, 1995, 57). Wenn allerdings innerhalb der ersten Stunde nach der Schlachtung filetiert wurde, erhöhten sich die Scherwerte (Young und Buhr, 1997; Young et al., 1996). Bei Puten variierte die Textur elektrisch betäubter Tiere 18 Stunden nach der Betäubung erheblich zwischen den unterschiedlichen Tierkategorien (Raj, 1995). Die Betäubung hatte keinen erkennbaren Effekt auf die Farbwerte gekochten Hühnerfleisches (Young et al., 1996) oder den Kochverlust (Papinaho und Fletcher, 1996).
Aus dem Vergleich der Ergebnisse bei 50 V Wechselspannung und 200 V Wechselspannung wurde geschlossen, dass 200 V Wechselspannung bei Broilern ohne nachteilige Beeinflussung des gekochten Fleisches eingesetzt werden konnte, solange die Standardzeit von 4 Stunden bis zum Entbeinen abgewartet wurde (Dickens und Lyon, 1993). Die elektrische Betäubung von Puten mit 200 mA mittels eines elektrischen Messer, das für 5 Sekunden angesetzt wurde, hatte keinen Einfluss auf den endgültigen pH-Wert der Muskulatur, die Farbe des rohen Fleisches, den pH-Wert des gekochten Fleisches, den Kochverlust oder den Scherwert im Vergleich zu mit Kohlendioxid betäubten oder unbetäubten Tieren, sofern das Fleisch 24 Stunden auf dem Knochengerüst gereift war (Northcutt et al., 1998).
Die Variationen in der Betäubung, Entblutung und Verarbeitung, die diesen Untersuchungen zugrundelagen, machen es zu einer schwierigen Aufgabe, hieraus Schlüsse zu ziehen. Dennoch scheint ein Einfluss der Elektrobetäubung auf die Fleischqualität nur in den ersten Stunden nach der Tötung nachzuweisen zu sein und sich innerhalb 24 Stunden zu verlieren. Dies trifft sowohl für den Vergleich mit anderen Betäubungsverfahren als auch verschiedene Stromstärken und Durchströmungszeiten zu. Somit dürfte eine Elektrobetäubung, die den Anforderungen des Tierschutzes genügt, keine nachteiligen Auswirkungen auf die Fleischqualität haben.

Nach der Richtlinie 93/119/EG muss die zuständige Behörde die Einhaltung der Anforderungen der Richtlinie während des Schlachtprozesses sicherstellen (Kapitel I Artikel 6 Nr. 1). In Deutschland ist die für die Überwachung des Tierschutzes in einem zugelassenen Schlachtbetrieb zuständige Behörde das Veterinäramt.
Die EG hat mittlerweile mit Inspektionen in Geflügelschlachtbetrieben in den Mitgliedstaaten begonnen, meist in Zusammenhang mit Inspektionen auf der Basis der Geflügelfleischrichtlinie 71/118/EEG. Die Inspektionsberichte werden im Internet veröffentlicht.

Official Journal of the European Communities No. L 340/21, 31.12.1993
Verordnung zum Schutz von Tieren im Zusammenhang mit der Schlachtung oder Tötung (Tierschutz-Schlachtverordnung - TierSchlV) vom 3. März 1997 (BGBl I S. 405), geändert durch Verordnung vom 25. November 1999 (BGBl I S. 2392)
Copyright Dr. Ingrid Schütt-Abraham